| 0.目次 1.はじめに 2.海馬神経および回路構造の基礎知識 2-1 海馬の3次元的な位置づけと層構造 2-2 主要細胞 2-3 介在細胞(インターニューロン) 3.海馬体の基本的な回路構造 4.海馬のシナプス回路 4-1 歯状回のシナプス結合 4-2 嗅内皮質からのシナプス入力 4-3 歯状回への海馬外からの投射 4-4 歯状回からの出力 4-5 CA3野のシナプス結合 4-6 その他の海馬領域からCA3への投射 4-7 CA2野のシナプス結合 4-8 CA1野のシナプス結合 4-9 海馬支脚のシナプス結合 5.海馬神経細胞の生理学・薬理学的な性質 5-1 一般的な反応 5-2 細胞外記録法 5-3 細胞内記録法 5-4 シナプス挙動にみる生理学的および生物物理学的な性質 5-5 抑制性シナプス 6 神経伝達物質の受容体 6-1 興奮性の神経伝達物質 6-2 抑制性の神経伝達物質 6-3 部位別考察 ─ 貫通線維 6-4 部位別考察 ─ 歯状回門線維 6-5 部位別考察 ─ 苔状線維 6-6 部位別考察 ─ CA3再帰回路 6-7 部位別考察 ─ シャッファー側枝 7.海馬のシナプス可塑性 7-1 短期可塑性 7-2 短期可塑性-促通 7-3 短期可塑性-テタヌス後増強 7-4 短期可塑性-抑圧 7-5 長期可塑性 7-6 長期可塑性-長期増強(LTP) 7-7 長期可塑性-長期抑圧(LTD) 8.海馬機能への考察 8-1 海馬と記憶・学習 8-2 海馬と疾患 1.はじめに 海馬は哺乳類の中枢神経系のなかでももっとも詳しく研究されている脳領域の一つである。これには二つの理由がある。 一つ目の理由は、解剖学的にも組織学的にも、ひと目でそれと分かる明確な構造をもっていることである。ヒトの「海馬(hippocampus)」はちょうど小指ほどの大きさになる。ギリシャ神話に登場する海神ポセイドン(ネプチューン)がまたがる海馬(4頭立ての馬車を引く架空の動物)の尾に形が似ていることから、ルネサンス後期のイタリアで活躍したボロ-ニャ大学の解剖学者アランティオ(Arantio)が、1587年にこの脳部位を「海馬(Hippocampus)と名付けた(ギリシャ語でHippoは「馬」を、Kamposは「海獣」を意味している)。海馬は雄羊の角に似ていることから別名として「アンモン角(Ammon’s horn)」と呼ばれることもある(エジプト神アンモンは羊の角を持っている)。海馬を神経科学者により魅力あるものにしているのは、しかしながら、その名前の巧妙さではなく、その解剖学的な形態構造にある。海馬の内部は美しい層を形成しているのである。つまり、神経細胞の細胞体と、その神経網のゾーンが層状に並んでいる。 海馬は「海馬体(hippocampal formation)」とよばれる大脳辺縁系の一部である。海馬体は、歯状回(dentate gyrus)、海馬、海馬支脚(subiculum)、前海馬支脚(presubiculum)、傍海馬支脚(parasubiculum)、嗅内皮質(entorhinal cortex)に分けられる。このうち、歯状回、海馬、海馬支脚は、細胞層が単層であり、その上下を低細胞密度の層と無細胞層が挟んでいる。そのほかの部位は複数の層からなっている。とりわけ歯状回と海馬にみられる単純な層構造は、神経解剖学や電気生理学の研究進展に貢献してきている。 海馬が魅力的である二つ目の理由は、1950年代前半ごろから海馬がある種の記憶や学習に基本的な役割を演じていることが認知されるようになったからである。とりわけ、1957年に出されたScovilleとMilnerの報告は神経心理学に重要な一石を投じた。これはHMというイニシャルをもつ患者の報告である。おそらくHMは神経心理学の分野ではもっとも詳しく検査された人物である。彼はてんかんの治療の目的で両側の海馬を取り除く手術を受けたが、その後、新しい情報を長期記憶に留める能力が永遠に欠如してしまったのだ。この発見を機に、海馬は、記憶・学習の脳内メカニズムを理解しようという風潮から、神経解剖学、生理学、行動学などの分野で盛んに研究されるようになった。現在では海馬と記憶の関係は疑いのないものとなっている。 海馬はまたてんかん発作の感受性からも興味深い。海馬はもっとも発作閾値が低い脳部位である。ほとんどのてんかん患者は海馬が起始となった発作を示し、こうして海馬が焦点となった発作は、薬で治療するのが困難であることが多い。また、海馬体の一部分、とりわけ嗅内皮質は、アルツハイマー病でもっとも先に病変が現れるし、虚血や無酸素状態に高い脆弱性を示すのも海馬である。 海馬は、解剖学的および機能的なその構造から、ほかの大脳皮質システムのモデルにもなっている。大脳皮質は最近5年ほどはよく研究されるようになってきてはいるものの、現在知られている中枢神経系のシナプス伝達に関する知見の多くは海馬体の研究に基づいたものである。海馬体に関する過去の知見の大多数は、歯状回か海馬を標本としている。そこで以下では海馬(それもラットの海馬)と歯状回について焦点を当てる。 2.海馬神経および回路構造の基礎知識 2-1 海馬の3次元的な位置づけと層構造 海馬の立体的構造を図1に示した。巨視的に眺めると、海馬はバナナのように細長く延ばされた構造をしていて、その長軸方向がアルファベットのC字型に弯曲している。軸の吻側は中隔核(septum)付近から始まり、間脳を巻き込むように伸び、外尾側の側頭葉へと伸びている。海馬の長軸のことを「septotemporal軸」、短軸方向を「transverse軸」と呼ぶ。 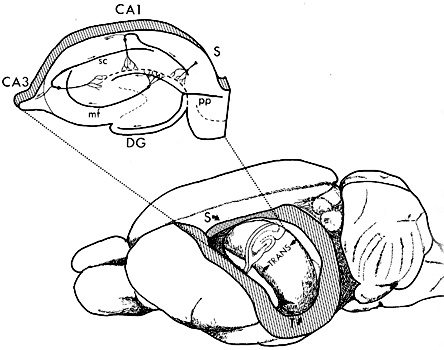 図1 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 海馬体に存在する各領域と層は図2に示した。歯状回は三層からなる。中心をなす層として「果粒細胞層(granule cell layer)」があり、すぐ上に位置するのが、細胞密度がきわめて低い「分子層(molecular layer)」、そして、下に位置する層は、細胞がまばらに見える「多形細胞層(polymorphic cell layer)」(または「門(hilus)」)である。海馬もまた「錐体細胞層(pyramidal cell layer)」と呼ばれる主要層があり、その上下にさらに細かい層(stratum)が走っている。これについてはまた後ほど述べる。 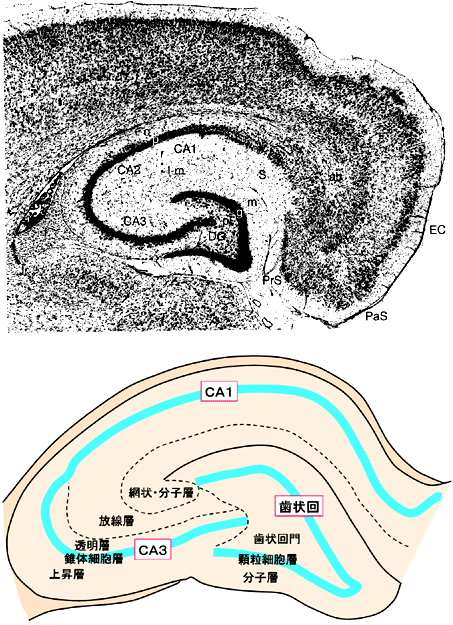 図2 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 2-2 主要細胞 歯状回に主要な細胞は果粒細胞(granule cell)であり、海馬では錐体細胞(pyramidal cell)である。錐体細胞層は細胞の大きさと形から、さらにCA1、CA2、CA3と3つに分類される(Lorente de No, 1934)。CAは、フランスの解剖学者ガレンジョ(Garengeot)が1742年に「アンモン角(cornu ammonis)」と名づけたことに由来している。 果粒細胞の細胞体は直径が10 μmほどの小さな球形であり、細胞体層の厚みの方向に4~6個ほど並んでいる。げっ歯類の果粒細胞層はV字またはU字型をしている(そのどちらかはseptotemporal軸に沿って異なる)(図3)。果粒細胞は樹状突起を、細胞体層と垂直の方向(分子層の方向)に伸ばし、そこで数種の細胞からシナプス入力を受けている。この樹状突起は、細胞体の尖った頂点様の部分のみから起始しているので、果粒細胞は「単極細胞(monopolar neuron)」と呼ばれることもある。果粒細胞の軸索は、そのシナプス終末の独特な外見から「苔状線維(mossy fiber)」と呼ばれている。苔状線維は細胞体の基底部(つまり樹状突起とは反対の方向)から起始し、歯状回門の中へと伸長している。苔状線維は苔状細胞(mossy cell)などいくつかの神経細胞に投射している。苔状線維は歯状回門をでると束になり、CA3野の透明層(stratum lucidum)に入りこむ。歯状回門の別名である「多形細胞層」という名前は、そこに多種多様な細胞があることを想像させるが、実際には、ここの細胞はすべて、歯状回内で局所投射している介在細胞だけである。 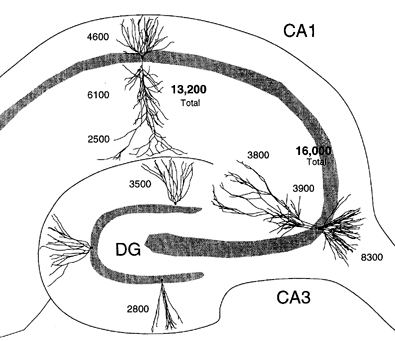 図3 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 海馬錐体細胞の細胞体は、錐体細胞層の厚みの方向に3~6個ほど同じ向きに並んでいる。錐体細胞は、細胞体層を挟んで両方向に樹状突起を伸ばしているため、「多極細胞(multipolar neurons)」と呼ばれることもあったが、この名はあまり一般的でない。尖端樹状突起(apical dendrite)は、細胞体の頂点側(錐体細胞は円錐形をしている)から起始し、海馬の中心方向(つまり歯状回側))へ伸びている(図3)。CA3野ではこの樹状突起は、透明層(stratum lucidum)、放線状層(stratum radiatum)、網状分子層(stratum lacunosum-moleculare)の三領域を縦に貫いている。逆に、より短い基底樹状突起(basal dendrite)は細胞の底辺から上昇層(stratum oriens)に伸びている。 海馬は二つの主要な部位にはっきりと分けることができる。歯状回に近い側である、大きな細胞がある領域と、遠い側であるより小さな細胞のある領域である。Ramon y Cajal(1911)は、これら二つの領域をそれぞれ「regio inferior」「regio superior」と名づけたが、Lorente de No(1934)は、海馬をCA3、CA2、CA1の三つに分けた。彼はCA4という言葉も使ったが、これは歯状回門に相当し、今ではCA4という言葉はラット脳では使われない。Ramon y Cajalの分類ではCA3野とCA2野がregio inferiorに相当し、CA1野がregio superiorに相当する。CA3野とCA1野に存在する錐体細胞は、細胞の大きさだけでなく、神経回路網も異なっている。CA3野の錐体細胞は歯状回から苔状線維からの入力を受けているが、CA2野とCA1野の錐体細胞の受けていない。 CA2領域は誤解を与えやすい部位である。Lorente de Noによって定義されたように、CA2はCA3とCA1に挟まれた狭い領域であり、CA3錐体細胞のように大きな細胞体を持つにもかかわらず、CA1錐体細胞と同じく苔状線維からの入力を受けていない。CA2は解剖学的にも機能的にも海馬のそのほかの部位とは異なる。たとえば、CA2はCA3やCA1に比べ、てんかん発作による細胞死がそれほど起こらず、時には「抵抗区域(resistant sector)」とさえ呼ばれることもある(Corsellis and Bruton, 1983)。 興奮性入力はスパイン(spine)の上にシナプスを作るが、錐体細胞の樹状突起はスパインに覆われている。とりわけ、苔状線維がシナプスを作るCA3錐体細胞の近位樹状突起にある「棘状瘤(thorny excrescence)」は、神経系でもとりわけ巨大なスパインである。棘状瘤は複雑に枝分かれしており、棘状瘤一個は苔状線維ボタン一個で覆われている。この他のCA3錐体細胞のスパインと、CA1錐体細胞のスパインは標準的な(つまり大脳皮質に似た)スパインを作っている。スパインは興奮性の非対称シナプスを形成している。 海馬錐体細胞の樹状突起の定量的な解析によれば、CA3神経細胞の樹状突起は個々にかなりばらついていることが分かる(Ishizuka et al., 1995)。歯状回に近い場所にあるCA3c野の錐体細胞は、樹状突起の総計長が短く、CA1に近づくほど長くなる。CA1錐体細胞では場所によらず樹状突起はほぼ一定で、平均すると全長は約12,000~13,000 μmである(Ishizula et al 1995; Megias et al., 2001)。Migialら(2001)は、平均的なCA1錐体細胞は興奮性入力を30,000、抑制性入力を1,700ほど持っていると見積もっている。抑制入力は尖端樹状突起の近位に多く、スパインを介さずに軸(shaft)に直接入力している(Papp et al., 2001)。 錐体細胞層以外の層にある神経細胞は介在神経(インターニューロン、interneuron)と推定されるが、必ずしも当てはまらない場合もある。たとえば、Gulyasら(1998)は、CA1放線状層に大きな細胞を見出している。この細胞は樹状突起にスパインを有しており、軸索は海馬采(fimbria)に向かい、ミエリン化されていて太い。 2-3 介在細胞(インターニューロン) 介在細胞(または内因細胞)は古来、局所に集中した軸索叢(plexus)を持ち、GABAを放出し、樹状突起にスパインがない神経細胞として定義されている。細胞標識法や記録法などが進歩し、介在細胞は従来考えられていたよりもはるかに多様であることがわかり、伝統的な定義だけでは、どれも必ず例外が現れてしまう(Buckmaster and Soltesz, 1996)。ただ実際のところ、歯状回や海馬の介在細胞のほとんどは、シナプス標的を局所に持ち、スパインを欠き、GABA性である(Freund and Buzsaki, 1996)といって間違いない(図4)。 歯状回のもっとも重要な介在細胞は錐体籠細胞(pyramidal basket cell)である。この細胞は果粒細胞層と歯状回門の境界付近に存在し、果粒細胞の細胞体に投射している。籠細胞には少なくとも5つの亜種が存在する(Ribak and Seress, 1983)。分子層にも介在細胞が存在する。その中でおそらくもっとも興味深い細胞種は、軸索軸索間細胞(axo-axonic cell)であろう。これは、軸索が果粒細胞の軸索起始部に投射するのでこう呼ばれている(Kosaka, 1983)。歯状回門にも多種の介在細胞が存在する。歯状回門の中だけに投射する介在細胞もあれば、果粒細胞層や分子層に投射する介在細胞もある。この中に苔状細胞(mossy cell)と呼ばれる介在細胞がある(Amaral, 1978)。これは興奮性細胞であり、同側および対側の歯状回の分子層だけに投射する。これを“興奮性介在細胞”などとよぶ研究者もいるが、両側の海馬に投射するその長い軸索は、いわゆる介在細胞の“古典的定義”には反する。実際に、苔状細胞は局所的に投射すると言うよりも、歯状回のseptotemporal方向の遠くに投射する傾向がある。したがって、苔状細胞は、伝統的な意味では、介在細胞の定義にも主要細胞の定義にも属さないことになる。 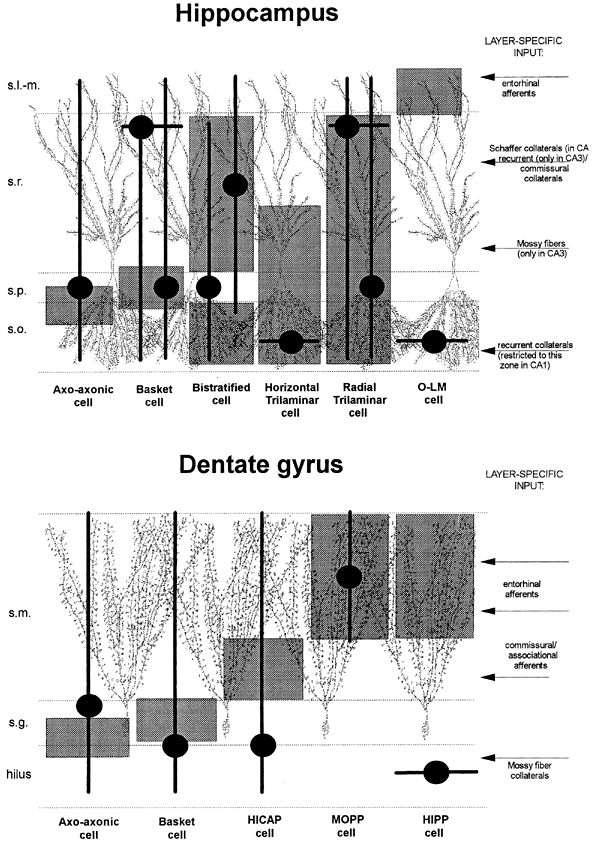 図4 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 海馬の介在細胞も、存在する場所やシナプス標的によって、大きく3つのグループに分けられる。すなわち、軸索軸索間細胞、籠細胞、重層状細胞(bistratified cell)である。その名前が示すように、軸索軸索間細胞は、錐体細胞の軸索起始部にシナプスを作っていて、活動電位の開始に強い影響を及ぼしている。籠細胞は錐体細胞の細胞体にシナプスを形成している。一つの錐体細胞に対して多重にシナプスを形成しており、その神経網が錐体細胞の細胞体を包む“籠”のようになっていることからこの名が付いている。最後の重層状細胞は、錐体細胞の尖端樹状突起と基底樹状突起の両方に投射している。つまり、この三種の介在細胞の軸索出力の標的には領域的にほとんど重なりはないが、樹状突起については、三種いずれも放線状層や上昇層に投射しており、シャッファー側枝(Schaffer collaterals)や交連・連合線維(commissural-associational fibers)や、近傍の錐体細胞からの局所入力を受けているようである(Buhl et al., 1996; Halasy et al., 1996)。また、介在細胞同士の間に、相互に抑制を掛ける回路が存在することもわかっている。相互抑制回路は、介在細胞の活動を同期させ、シータ波(5 Hz)やガンマ波(40 Hz)など、様々な周波数の振動(oscillation)を発生させる役割をしていると考えられている(Jefferys, 1996)。多くのGABA性介在細胞は、同時に神経ペプチドを含んでおり、時には放出することも知られている。 3.海馬体の基本的な回路構造 海馬体のおおまかな神経回路はRamon y Cajal(1911)の時代から知られているが、その詳細は最近の研究によって解明されたものである(図5)。Andersenら(1971)は海馬体の各部位を一方向につなぐ特徴的な回路の重要性を主張し、これを「三シナプス性回路(trisynaptic circuit)」と名付けた。感覚情報の多くは嗅内皮質を通じて海馬に流れ込むので、嗅内皮質を三シナプス性回路のスタート地点と考えることが多い。嗅内皮質は、隣り合った二つの皮質領域から情報を受信している。すなわち、嗅周囲皮質(perirhinal cortex)と嗅後部皮質(postrhinal cortex)(霊長類では海馬傍回(parahippocampal cortex)と呼ばれる)が、複次的な感覚情報を嗅内皮質にリレーしている(Burwell, 2000)。この入力の多くは興奮性である(Martina et al., 2001)。膨大部後方皮質(retrosplenial cortex)もまた感覚情報の源となっているらしい(van Groen and Wyss, 1992, Wyss and van Groen, 1992)。 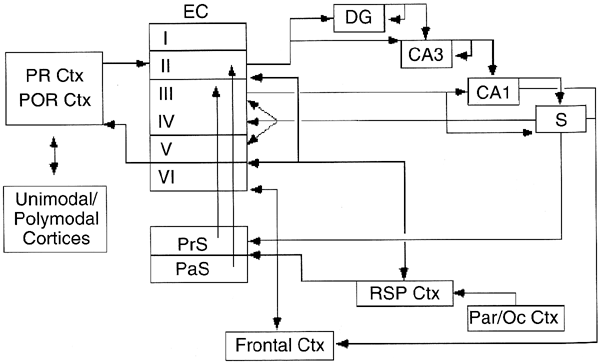 図5 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 嗅内皮質の第Ⅱ層に存在する神経細胞は、「貫通線維(Perforant Path)」という通路を経由して、歯状回や海馬のCA3領域に投射している。貫通線維という名前は、軸索が海馬支脚を“貫いて”、軸索が投射していることに由来している。内側嗅内皮質の細胞は歯状回分子層の中間層に特異的に投射し、一方、外側嗅内皮質は分子層の外側三分の一の部分に投射している。これらの二種の貫通線維は、CA3やCA2の網状分子層にも同様な層状パターンを形成している。 嗅内皮質第Ⅲ層の神経細胞は、歯状回やCA3には投射せず、CA1や海馬支脚に投射している。この投射は層の構造があまり明確でなく、むしろ地理的に秩序を持って配置されている。つまり、外側嗅内皮質から来る軸索はCA1と海馬支脚の境界付近の網状分子層に投射しており、内側嗅内皮質はCA3寄りのCA1c網状分子層と、海馬支脚のうち前海馬支脚側の分子層に投射している。 歯状回は三シナプス回路の次のステップを担っている。歯状回は苔状線維を通じてCA3錐体細胞の近位樹状突起に投射している。果粒細胞はまた歯状回門の苔状細胞に投射し、この苔状細胞は、他のseptotemporalレベルにある歯状回(同側&対側)とシナプスを形成している。CA3錐体細胞は、CA1錐体細胞だけでなくCA3錐体細胞にも強い投射をしている。このうちCA1錐体細胞への投射軸索は「シャッファー側枝(Schaffer collateral)」と呼ばれている。CA1錐体細胞は嗅内皮質の深層(第Ⅳ、Ⅴ、Ⅵ層など)と海馬支脚に投射している。海馬支脚もまた嗅内皮質の深層に投射している。そして、深層の嗅内皮質は、嗅内皮質に情報をもともと送っていた他の皮質領野へと投射している。こうして、特定の皮質領域から嗅内皮質へ入力された情報は、上に記したような興奮性の回路を通じて海馬全体を巡り、最終的に同じ場所に帰ってくることになる。情報はこの回路を巡回する間に加工され、この処理工程がおそらく長期記憶に情報を留めるために重要なのだと考えられる。 以上が、海馬体の基本的な神経回路網である。引き続き歯状回と海馬のシナプス組織をより詳細にみていく。 4.海馬のシナプス回路 4-1 歯状回のシナプス結合 歯状回の果粒細胞は、苔状線維という無髄軸索を伸ばしている(図6)。苔状線維はCA3に突入する前に、歯状回門で一本あたり平均7本の細い側枝を出している(Claiborne et al., 1986)。この側枝は大小二つの異なるタイプのシナプス瘤(synaptic varicosity)を持っている。0.5-2 μmほどの小さいシナプス瘤は苔状線維一本あたり約160個ほど存在し、歯状回門の介在細胞のスパインや樹状突起と接触している(Claiborne et al., 1986)。そして、側枝の終端部には、3-5 μmほどの大きなシナプス瘤が、通常一つだけ付いている。これは不規則な形をした膨潤で、形態がCA3野の苔状線維シナプス終末と類似している。歯状回門に見られる巨大な終末は、苔状細胞の近位樹状突起や、錐体籠細胞の基底樹状突起、そのほかの細胞とシナプス接合を作っている(Ribak and Seress, 1983; Ribal et al., 1985; Scharfman et al., 1990)。Acsadyら(1998)は、苔状線維一本は7-12個の苔状細胞とシナプスを作っていることを示している。さらに驚くべきことに、苔状線維の側枝や巨大シナプスから出る糸状仮足(filopodia)の大多数が、介在細胞に投射しているということである。実際、歯状回や海馬のパルバルブミン(parvalbumin)陽性介在細胞に投射する興奮性シナプスの95%は、苔状線維由来である(Seress et al., 2001)。 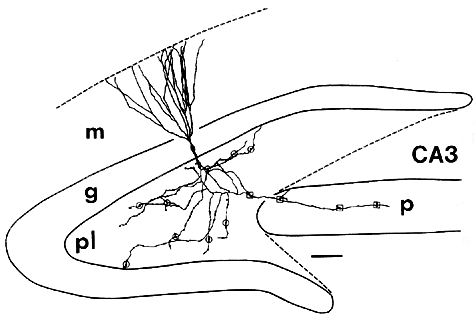 図6 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より すでに述べたように、果粒細胞層の近くに存在する籠細胞にはたくさんの種類が知られている。すべての籠細胞は果粒細胞層に非常に綿密な軸索叢を形成している。これは果粒細胞の細胞体や樹状突起の軸に見いだされ、終末はGABAを含んでおり、対称性シナプスであるので、おそらく抑制性の入力である(Kosaka et al 1984)。歯状回門のGABA性神経もまたGABA性入力を受けている(Misgeld and Frotscher, 1986)。籠細胞一つの影響力はどのくらい大きいだろうか。ゴルジ染色法を用いた解析によれば、籠細胞の軸索網はtransverse軸に400 μm、septotemporal軸には1.1 mmほど広がっているという(Struble et al., 1978)。すなわち、籠細胞は一個で相当な数の果粒細胞を神経支配していると想定される。 果粒細胞に入る二つめの主要な抑制入力は、分子層に存在する軸索軸索間細胞(またの名をシャンデリア細胞(chandelier-type cell)という)からのものである(Kosaka, 1983; Soriano and Frotscher, 1989)。この細胞もまた対対称性シナプスを形成するが、投射先は果粒細胞の軸索起始部のみである。歯状回門全体にわたってまばらに存在するソマトスタチン(somatostatin)陽性細胞もまた歯状回の内部でのみ投射する細胞である(Morrison et al., 1982; Baks et al., 1986)。この細胞はGABAを含んでおり、分子層の外側の部分で神経叢を作っている。つまり、果粒細胞の遠位樹状突起でシナプスを作っており、そこで果粒細胞の活動をコントロールしている(Freund and Buzsaki, 1996)。この細胞の標的の76 %は果粒細胞であるが、そのほかの介在細胞にも強く投射しているようである(Katona et al., 1999)。 分子層の内側三分の一の部分に見られるシナプス入力はすべて歯状回門からのものである(Blackstad, 1956; Laurberg and Sorensen, 1981)。この投射は同側だけでなく対側の歯状回にも由来しているので、同側連合交連投射(ipsilateral associational-commissural projection)と呼ばれている。この投射は苔状細胞の軸索側枝であると考えられている(Laurberg and Sorensen, 1981)。終末はほぼ非対称性シナプスであり、果粒細胞のスパインに投射しているので、興奮性であると思われる(Laatsch and Cowan, 1967; Kishi et al., 1980)。苔状細胞はグルタミン酸に免疫陽性であるので(Frotscher, 1993)、おそらく同側連合交連投射のシナプスもグルタミン酸作動性であろう。 苔状細胞は果粒細胞から強い投射を受けているので、その軸索はフィードバックのループを形成していることになるが、しかし、このループがあまり重要でないことを示唆する事実がある。果粒細胞は同じseptotemporal面内で苔状細胞に投射している。しかし、苔状細胞は同じ面内では果粒細胞には投射していない。むしろseptal側かtemporal側に投射している。つまり、苔状細胞は果粒細胞の出力を、septotemporal軸に沿って遠くの歯状回へと伝える役割をしているようだ。ただし、苔状細胞の長軸方向への投射の、本当の意味はまだ完全には分かっていない。さらに、同側連合交連投射は果粒細胞だけでなく、籠細胞の樹状突起軸にもシナプス結合をしている(Frotscher and Zimmer, 1983; Seress and Ribak, 1984)。したがって、同側連合交連投射は興奮性のフィードバック回路と同時に、フィードフォワード抑制として働いている可能性もある。さらにもう一つ、こうした議論に影響する因子がある。それは歯状回門のソマトスタチン細胞である。この細胞は苔状細胞よりも、さらに空間的に局在した神経投射をしている。従って、苔状線維の側枝がソマトスタチン細胞を活性化させると、それは同じseptotemporal面内で、より直接的に果粒細胞を抑制することになる。つまり、同側連合交連投射による興奮制御は、より遠くの歯状回に限定されるようになる。いずれにしても、同側連合交連投射が主に影響を与える果粒細胞がある程度離れた細胞であるという事実は、従来しばしば言われてきた、海馬が層内(つまり海馬バナナのスライス内で)でのみ情報を処理するという仮説と矛盾することは確かである(Amaral and Witter, 1989)。 4-2 嗅内皮質からのシナプス入力 歯状回への主要な入力は嗅内皮質からのものである。この投射の主な特徴はすでに述べた。歯状回への投射は主に嗅内皮質の第Ⅱ層から起始している(Steward and Scoville, 1979; Schwartz and Coleman, 1981; Ruth et al., 1982, 1988)が、わずかに第Ⅳ~Ⅵ層の深層から起始するものも存在する(Kohler, 1985)。貫通線維の終末は歯状回の分子層の外側(表層側)の三分の二の層に限局し、そこで非対称のシナプスを作っている(Nafstad, 1967)。その多くは果粒細胞のスパインに見いだされるが、一部、籠細胞に投射するものもある(Zipp et al., 1989)。分子層の外側三分の二に存在するシナプスの少なくとも85%は貫通線維シナプスであり(Nafstad, 1967)、おそらくグルタミン酸作動性である(Fonnum et al., 1979)。また貫通線維のうち、歯状回に投射するものについて言えば、外側貫通線維はエンケファリン(enkephalin)陽性であり、内側貫通線維はCCK陽性であることがわかっている(Fredens et al.,1984)。 4-3 海馬外からの歯状回への投射 歯状回は皮質下からも入力を受けている。主な入力元は中隔核、乳頭体(supramamillary region、これは視床下部後葉に存在する小さな脳部位)などであるが、青斑核(locus coeruleus)や縫線核(raphe nuclei)からのモノアミン系の投射も受けている。 中隔系の投射は、内側中隔核やブローカー対角束核(nucleus of diagonal band of Broca)に由来しており、海馬采、背側脳弓(dorsal fornix)、脳梁上部(supracallosal stria)、もしくは扁桃体(amygdala)周辺の腹側路の4つの経路のいずれかを伝って海馬体に流れ込む(Mosko et a., 1973; Swanson, 1978 Amaral and Kurz, 1985)。中隔系入力は、歯状回門(とりわけ果粒細胞層のすぐ下の狭い部分)に強い投射をしており、わずかではあるが分子層にも投射がみられる。内側中隔核からの投射の30~50%、ブローカー対角束核からの50~75%はコリン作動性である(Amaral and Kurz, 1985; Wainer et al., 1985)。電子顕微鏡を用いた詳しい検討はそれほどなされていないが、歯状回に存在する多種な神経細胞がコリン作動性の神経支配を受けているようだ。実際、Dellerら(1999)は苔状細胞がコリン支配を受けていることを示している。しかし、中隔核に起始する投射の多くは、グルタミン酸脱炭酸酵素(glutamic acid decarboxylase)を含んでおり、GABA作動性である可能性が高い(Kohler et al., 1984)。中隔核からのGABA作動性神経は、しばしば歯状回のGABA性の介在細胞に投射しているようである。中隔核のGABA性神経は、GABA作動性にも拘わらず、いわゆる“介在細胞”ではなく、長距離投射の神経細胞群であるということは特筆すべき事実である。 視床から歯状回に入る唯一の主要経路は乳頭体からのものである(Wyss et al., 1979; Dent et al., 1983; Haglund et al., 1984)。乳頭体からの投射は主に、果粒細胞層のすぐ上の分子層のごく狭い領域に終止しているが、歯状回門にもわずかな投射が認められる。 歯状回は青斑核からノルアドレナリン性神経の強い神経支配を受けており(Pickel et al., 1974; Swanson and Hartman, 1975)、これは主に歯状回門に投射している。縫線核からのセロトニン作動性の投射もまた主として歯状回門に投射しているが、その投射先は果粒下(subgranular)領域のみに限られているようだ(Conrad et al., 1974)。Freundら(1991)は、セロトニン性神経は主に、遠位分子層に投射する特定のタイプの介在細胞に投射していることを示しているものの、コリン作動性のときと同じように、青斑核から投射する細胞の多くはどうやらセロトニン作動性ではないらしい(Kohler and Steinbusch, 1982)。歯状回は全体にわたりドパミン作動性神経の比較的弱い投射も受けているが、これは腹側被蓋核(ventral tegmental area)からの投射である。 4-4 歯状回からの出力 歯状回は海馬体の外には投射していない。さらに海馬体の中に限ってみても、苔状線維を通じてCA3領域に投射するのが唯一の歯状回からの出力である。歯状回門を出て、CA3領域に入った苔状線維は、ほとんど側枝を出さない。透明層の中を束状になって、CA3全体にわたって伸長している。透明層の中では、苔状線維は3-6 μm径という巨大なシナプス終末を形成し、そこでCA3野錐体細胞と接触している(Claiborne et al., 1986)。こうした巨大なシナプス瘤は、苔状線維に沿ってほぼ140 μm毎の間隔で存在している。歯状回に近い部分のCA3野では、一部の苔状線維は錐体細胞層の深い部位を通過している。これは錐体下束(infrapyramidal bundle)と呼ばれている。この部位では苔状線維は、錐体細胞の細胞体に近い(近位の)尖端樹状突起と基底樹状突起の両方で巨大シナプス瘤を形成している。 苔状線維のシナプス前終末は、「棘状瘤(thorny excrescence)」と呼ばれるユニークな構造とシナプスを形成している(図7)。多い場合では16本もの棘状の突起がひとつの棘状瘤から出ており、それらは単一の苔状線維終末で覆われている。単一の苔状線維終末は最大37個ものシナプス接点を含んでおり、それらはすべて一つのCA3野錐体細胞と結合しいる(Chicurel and Harris, 1992)。このようにサイズが大きいという事実、そして、樹状突起の近位に投射しているという事実から、海馬錐体細胞の活動への影響力という意味で、果粒細胞は独特の地位にある。ただし、苔状線維はかなり少数の錐体細胞としか結合していない。おそらく、苔状線維一本あたりの標的の錐体細胞は最大でも14個程度であろう(Claiborne et al., 1986; Acsady et al., 1998)。 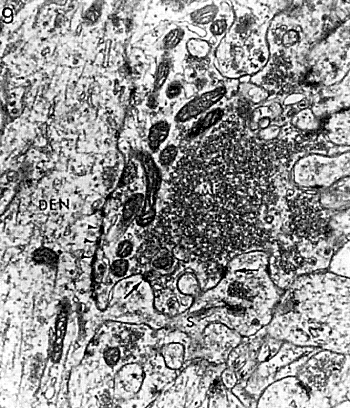 図7 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 苔状線維は、その起始細胞と同じseptotemporal面内で投射している(Gaarskjaer, 1978; Swanson et al., 1978; Claiborne et al., 1986)。この点は、苔状細胞の同側連合交連投射がseptotemporal軸方向により強く投射するのとよい対照をなしている。しかしながら、CA3とCA2野の境界付近で、苔状線維は突然向きを変え、temporal側に1 mm以上も伸びている。この機能的な意味は分かっていない。 苔状線維は主にグルタミン酸を伝達物質として利用していると考えられているが(Storm-Mathisen and Fonnum, 1972)、部分的にはダイノルフン(dynorphin)やエンケファリン(enkephalin)も含んでいる苔状線維も存在する(Gall et al., 1981; Gall, 1984; van Daal et a., 1989)。最近では、苔状線維がGABA陽性であることも示されているが(Sloviter et al., 1996)、実際のシナプス伝達に関与しているのか、または何か別の代謝的意味があるのかは不明である。 4-5 CA3野のシナプス結合 CA3野の錐体細胞は非常に側枝化された軸索を持っており、それらの線維は、海馬内(CA3、CA2、CA1野)や、対側の海馬(交連投射、commissural projection)、もしくは中隔核に投射している。CA3野の錐体細胞(とりわけ歯状回に近いCA3c部位の細胞)とCA2野の錐体細胞は、歯状回門にもわずかながら投射している。 CA3とCA2の錐体細胞は例外なく、海馬の全領域へ分散的な投射を行っている(Ishizuka et al., 1990)。このうちCA3とCA2に投射するものは、「連合線維(associational connection)」と呼ばれており、CA3からCA1への投射は「シャッファー側枝(Schaffer collateral)」と呼ばれている。CA3からCA3へ、およびCA3からCA1への投射の空間的配置は明瞭であり(Ishizuka et al., 1990)、これについては後に述べる。 すべてのCA3とCA2錐体細胞はCA1への投射を持っているが、そのシナプス終末の空間配置は起始細胞の空間配置と鏡像の関係にある。古くは、CA3野の錐体細胞は一本の軸索をCA1の全領域に対して均等に送っており、そこで偏りなくシナプス結合を形成しているとされていたが、これは明らかに誤りである。むしろ、特定のCA3錐体細胞は特定の場所に存在するCA1錐体細胞により高確率で投射している。歯状回に近い位置に存在するCA3cの錐体細胞は、septal側にもtemporal側にもかなりの距離まで投射しているものの、どちらかといえばseptal側のCA1に投射する傾向がある。逆に、CA1野に近いCA3a錐体細胞は、むしろtemporal側のCA1野により強い投射をしている。Septotemporal軸の面内での投射について言うのならば、CA3の中でも近位(CA3c)に位置する細胞はCA1野放線状層の浅い部分(網状分子層に近い部分)に投射し、遠くに位置する細胞(CA3a)は、CA1野放線状層の深い部分(細胞体層に近い部分)または上昇層に投射している。同様にして、歯状回に近いCA3c錐体細胞は、CA1のなかでも遠いCA1a部分(つまり海馬支脚に近い部分)に投射する傾向があり、CA3a錐体細胞はCA2との境界付近に存在するCA1cに投射する傾向がある。 septotemporal軸、transverse軸に拘わらず、一般に、高密度にラベルされる終末(および線維)は、起始細胞からseptal側のレベルでは、CA1野放線状層の細胞体側の部分または上昇層に、また、起始細胞からtemporal側のレベルでは、上昇層の投射はなく、CA1野放線状層の網様分子層側に投射する。シャッファー側枝はしばしば放線状層だけに投射しているように勘違いされがちだが、上昇層にも同じくらい強く投射しているという事実にはもっと目を向けられるべきである。つまり、シャッファー側枝はCA1錐体細胞の尖端樹状突起と基底樹状突起の両方に強い影響を与えていることになる。また、放線状層を走った後に上昇層に入り込むシャッファー側枝さえもあり、この場合には同一の軸索が、尖端樹状突起と基底樹状突起の両者に投射していることになる(ただし別のCA1錐体細胞であるが)。 一つのCA3錐体細胞が多数のCA1錐体細胞に投射していることは重要である。一つのCA1錐体細胞は、少なくとも5000の同側CA3錐体細胞から投射を受けていると想定されている(Amaral et al., 1990)。このシナプスは非対称型で、CA1樹状突起のスパインに結合している(図8)。スパインやシナプス終末の大きさや形は、一定でなく、かなりばらついており、CA1シナプスの生理的な意義に関与しているのではないかと考えられている。ShepherdとHarris(1998)は電子顕微鏡で75ものシャッファー側枝断片を解析するという非常に骨の折れる作業を行った。彼らはシナプスが軸索に沿いだいたい2.7 μmの間隔で存在することを発見した。このうち68%のシナプスが単一のシナプス後部肥厚(postsynaptic density)を有しており、19%が2~4個、13%にはシナプス後部肥厚は見つからなかった(ここではシナプス小胞が集積している場所をシナプスと定義している)。 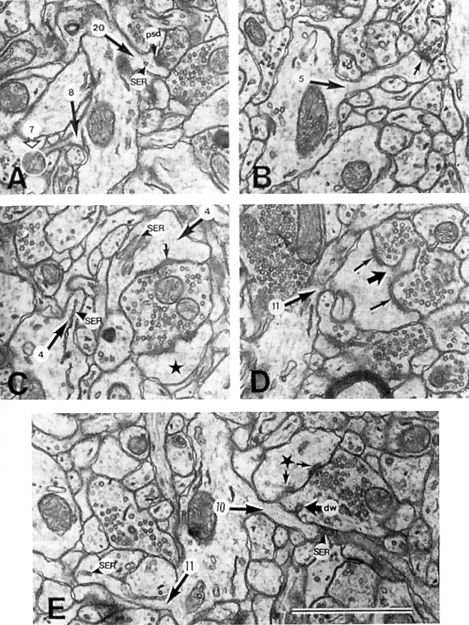 図8 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より CA3からCA3へ投射する連合線維もまた高度な秩序をもった投射形態をもっており、やはり放線状層と上昇層の両者全体にわたって投射している。この投射に特有な性質は、歯状回の近くに存在するCA3c錐体細胞は、septotemporalレベルで近い位置に存在するCA3錐体細胞に主に投射しているということである。一方、より遠位のCA3a錐体細胞はtransverse面全体に投射しており、septotemporal方向への投射もかなりある。 連合線維(CA3-to-CA3)とシャッファー側枝(CA3-to-CA1)の重要な特徴は、septotemporal方向へ強い投射があるということである。一個のCA3(またはCA2)錐体細胞の軸索網だけで、海馬のseptotemporal軸の75%をも埋め尽くしている(Tamamaki et al., 1984, 1988)。Liら(1994)は細胞内標識法によって、CA3錐体細胞一つでも、その軸索叢の総計長は150-300 μmにも達し、30000-60000個も標的細胞を持っていることを明らかにした。 ラットでは、サルとは異なり(Amaral et al., 1984; Demeter et al., 1985)、CA3錐体細胞は対側海馬のCA3、CA2、CA1領域にも交連線維を送っている(Swanson et al., 1978)。一つの錐体細胞が、同側と対側に同時に投射している(Swanson et al., 1980)。多少の左右差はあるものの、交連線維は大まかには連合線維と似たような空間配置をとり、同側海馬と類似した部位へ投射をしている。たとえば、ある線維が同側の放線状層のある場所に強い投射していたのならば、この線維は対側でも放線状層の同じ部位ににより強い投射をしている(Swanson et al., 1978)。歯状回の交連線維の場合と同様、対側に投射するCA3線維も、スパイン上に非対称型のシナプスを作っており(Gottlieb and Cowan, 1972)、介在細胞には滑らかな樹状突起上に直接シナプスを作っている(Frotscher and Zimmer, 1983)。 4-6 その他の海馬領域からCA3への投射 1970年代中頃から、前脳基底部(basal forebrain)や終脳などの皮質下投射する線維はすべて、CA1やCA3などの海馬領域から始まっていると考えられてきた。しかしSwanson and Cowan(1975)は、こうした投射のほとんどは海馬支脚から起始していることを明らかにした。CA3からの唯一の皮質下投射は外側中隔核に向かうものである(Swanson and Cowan, 1977)。CA3から中隔核への投射は両側性であり、この点はほかの海馬領域からの投射と異なっている。面白いことに、実質上すべてのCA3錐体細胞はCA1と外側中隔野の両方に投射している(Swanson et al., 1980)。また、中隔核への投射する海馬神経にはGABA性のものがあることは留意しておいたほうがよいだろう(Toth and Freund, 1992)。 CA3野への皮質下入力の主要なものは中隔核からのものである。歯状回のときと同じく、中隔核からの投射は、主に、内側中隔核とブローカー対角束核から来ている。この投射は、主に上昇層に終止しており、放線状層に投射するものは少ない(Nyakas et al., 1987; Gaykema et al., 1990)。やはり歯状回のときと同様、GABA性の入力は主にGABA性の介在細胞に投射している(Freund and Antal., 1899; Gulyas et al., 1990)。 CA3野はまた青斑核からノルアドレナリン性の入力を受けている。この神経終末のうち太い線維のものは主に網状分子層の最表層部と透明層に密集しているが、細い軸索叢はCA3全体にわたって分布している。セロトニン作動性はCA3に広くまばらに投射しており、ドパミン性の神経支配はきわめて少ない(Swanson et al., 1987)。歯状回と同様、セロトニン作動性の投射はまばらだとはいえ、錐体細胞の遠位樹状突起に投射するタイプの介在細胞にシナプスを作る傾向がある(Freund et al., 1990)。 4-7 CA2野のシナプス結合 CA2領域は苔状線維の終結部に位置する比較的狭い領域である。その幅は通常250 μm以下である。錐体細胞はCA3と似ていて、大きく暗っぽく見える。しかし、CA2の細胞にはCA3錐体細胞の特徴にもなっている巨大棘はない(Lorente de No, 1937; Tamamaki et al., 1988)。免疫組織染色においてもCA2とCA3の差がいくつか観察される。CA2は、すぐ脇のCA3やCA1よりも、アセチルコリンエステラーゼ(acetylcholinesterase)やパルバルブミン(paralbumin)に対してより強い免疫染色陽性を示す(Bainbridge and Miller, 1982)。パルバルブミンはカルシウム結合タンパク質であり、虚血や興奮毒性に対して保護的に働くと考えられており、実際、CA2神経細胞はヒトのてんかんでも死なずに残っており興味深い(Corsellis and Bruton, 1983)。 CA2の海馬内投射はCA3a錐体細胞と類似しているが、異なる点も存在する。CA1に投射しているという点ではCA3錐体細胞と同じである(Ishizuka et al., 1990)が、その投射はCA3よりも低密度で分散的であって、CA3-to-CA1で見られるような明確なgradient則は見られない。面白いことに、CA2錐体細胞の軸索側枝は歯状回門にも投射しているが、この投射の程度はCA3錐体細胞よりも強い。 CA2の海馬外入力や出力に関してはあまりよく分かっていない。一般にCA2はCA3回路と共通点が多いものの、CA3とは異なりCA2は乳頭体(Haglund et al., 1984)や結節乳頭体核(tuberomammillary nucleus)(Kohler et al., 1985)から強い投射を受けている。 4-8 CA1野のシナプス結合 CA3とは異なり、CA1錐体細胞はCA1内であまり目立った軸索側枝(連合線維)を作っていない(Tamamaki et al., 1987; Amaral et al., 1991)。CA1の軸索は白板(alveus)や上昇層の中を海馬支脚に向かって走行するが、時折、その側枝が上昇層や錐体細胞層に進入している。これらの側枝はどうやら他のCA1錐体細胞の基底樹状突起とシナプスを作っているらしい(Deuchar and Thomson, 1996)。とはいうものの、CA3で見られるほどの濃密な連合線維はCA1に見られないことは明らかである。CA1野は対側海馬CA1に投射する交連線維も出している(Swanson et al., 1978)が、(入力or出力?)錐体細胞の数はそれほど多くない(van Groen and Wyss, 1990)。 CA1はCA3とほぼ同程度か、もしくはわずかに弱い投射を中隔核から受けている(Nyakas et al., 1987)。CA3と同様に、ノルアドレナリンとセロトニン作動性の投射もわずかながら受けている。CA1a野では扁桃体からの強い投射も受けている(Krettek and Price, 1977; Pitkanen et al., 2000)。扁桃体基底外側核からのCA1への入力は網状分子層に終止しているが、これは海馬長軸のtemporal側の三分の一の部分に限られているようだ。 視床からの海馬体への投射はなぜかそれほど注目されていない。視床前核(anterior thalamic nucleus)は海馬支脚や前海馬支脚と強固な相互結合を形成していることは知られているが、Herkenham(1978)は、視床正中核(もしくは全体)から海馬体への強い投射があることを明らかにした。とりわけ、正中結合核(midline nucleus reuniens)からCA1網状分子層への投射は強い。Wouterloodら(1990; Dolleman-Van der Weel and Witter, 1992)は、正中結合核からの投射は、海馬采/脳弓(fimbria/fornix)ではなく、内包(internal capsule)や帯状束(cingulum bundle)を通じて海馬に入力していることを報告している。正中結合核からCA1網状分子層への投射は、海馬septotemporal軸全体にわたって分布している。電子顕微鏡による解析で、この投射は網状分子層の細い樹状突起に直接か、もしくはスパインの上に、非対称シナプスを形成している。 CA1錐体細胞には二種の海馬体内の投射が存在する。一つはすぐ脇の海馬支脚への投射であり、これは整然とした空間的配置を持っている(Amaral et al., 1991)。もう一つは、嗅内皮質の深層への投射である(Naber et al., 2001)。 CA1錐体細胞の軸索は上昇層もしくは白板を伸長し、海馬支脚の方向に鋭く折れ曲がっている(Finch et al., 1983; Tamamaki et al., 1988; Amaral et al., 1991)。海馬支脚に到達した軸索は、錐体細胞層方向に再び入り込み、錐体細胞層および分子層中で網目状に細かく枝分かれする。gradient則に従ったCA3-to-CA1の投射とは異なり、CA1からの海馬支脚への投射はカラム状になっている。CA3に近い側CA1cからの投射は海馬支脚の遠位三分の一に投射しており、CA1aからの投射は境界を横切ってすぐの近位海馬支脚の部分に投射している。真ん中あたりのCA1bは海馬支脚の中心付近に投射している(Amaral et al., 1991)。Tamamakiら(1988)は、西洋ワサビペルオキシダーゼをCA1錐体細胞一個一個に注入し、個々の軸索を可視化することで、CA1軸索が海馬支脚の錐体細胞層の約三分の一の幅ごとに分かれて投射していることを示した。それ故にCA1から海馬支脚への投射は、その構造形態によって、三つに分けられることになる。 CA1野は嗅内皮質に情報を戻す最初の海馬の部位という意味で、歯状回やCA3/CA2とは決定的に正確を異にしている。CA1から嗅内皮質への投射は、海馬のすべてのseptotemporal軸およびtransverse軸から広く起始し、主に内側嗅内皮質へ投射しているが、一部は外側嗅内皮質へも投射している。これらの投射の多くは皮質第5層を標的としている(Swanson and Cowan, 1977; Finch and Babb, 1980, 1981; van Groen and Wyss, 1990)。 4-9 海馬支脚のシナプス結合 海馬支脚もまた海馬体の主要な出力成分を担っており、この部位を研究することは重要である。しかし、海馬支脚の主要細胞である錐体細胞の性質に関してはほとんど分かっていない(Harris et al., 2001)。この細胞の軸索もまた濃密な側枝叢を形成しており、海馬支脚のカラム構造を保持しているようだ。海馬支脚は前海馬支脚や嗅内皮質に投射しているが、皮質下領域へも投射しており、このうち主な投射先は、側坐核(nucleus accumbens)、視床前核、内側乳頭体、外側中隔核である。すでに述べたようにCA1から海馬支脚への投射はカラム状に鏡像関係になっている。面白いことに、海馬支脚から皮質や皮質下領域への出力における空間配置も、これに従っているようだ(Naber and Witter, 1998; Ishizuka, 2001)(ただし、この点に関する研究はまだ十分でない)。Ishizukaら(2001)は、異なる皮質下領域へ投射する錐体細胞は異なる細胞体直径を持っていることを示している。視床前核へ投射する錐体細胞はもっとも小さく、側坐核へ投射する錐体細胞は中間径で、内側乳頭体への神経細胞はもっとも大きいといった具合である。海馬支脚やこの周辺部位である前海馬支脚、傍海馬支脚の投射構造は、今後つぎつぎと解明され、注目を集める部位になるだろう。 5.海馬神経細胞の生理学・薬理学的な性質 5-1 一般的な反応 海馬がvivoおよびvitroの両者において理想的なシナプス研究の標本となっているのは、整然と組織化されたシナプス経路を持っているからである(Andersen et al., 1971)。貫通線維、苔状線維、シャッファー側枝の単回電気刺激は、その標的神経細胞に一連の興奮と抑制反応を引き起こす。一般的には、抑制は興奮よりも数ミリ秒遅れて生じるが、ときに両者は時間的にオーバーラップする(Barrionuevo et al., 1986)。抑制は、すでに述べたようなフィードフォワード回路やフィードバック回路から生じるものであり、しばしば早期相と遅延相を持っている(つまり二相性)。海馬から記録を行った初期の研究は主にvivoにおける場電気記録を用いていた(Langmoen and Andersen, 1981)。 5-2 細胞外記録法 集合場電位(細胞外)記録法とは、記録電極周囲にある複数の神経細胞から集合的な応答を記録する方法である。錐体細胞とその樹状突起はきちんとした列をなして並んでいるので、神経活動によって生まれる電場はseptotemporal軸と細胞層軸に対しては対象性を持っており、逆に樹状突起-細胞体軸に対しては非対称である。この二つの対称軸と一つの非対称軸の組み合わせ構造が、海馬の場電位記録を意味のあるものにしている。たとえば、適切にコントロールされた条件下では場電位の時間経過は、シナプス電流の時間経過とほぼ一致する(Johnston and Wu, 1995)。さらに樹状突起-細胞体軸沿いに複数の電極を並べ、いわゆるcurrent source density(CSD)解析という技術を使うことで、シナプス応答が起きている部位をおおよそ同定することができる(Haberly and Shepherd, 1973; Richardson et al., 1987)。 興奮性伝達ではシナプス電流は樹状突起内に流れ込むため、放線状層に置かれた記録電極では、シナプス前終末の一斉発火を反映した小さな陰性電位、つまり「線維斉射(fiber volley)」が記録され、さらにその後、ゆっくりとした陰性(マイナス)電位が観察される(陰性電位は「シンク(sink)」と呼ばれる)。これは興奮性シナプス電流と類似した時間経過を示す(図9A下)。このゆっくりとした成分は興奮性シナプス後場電位(fEPSP、field excitatory postsynaptic potential)と呼ばれており、神経細胞の集合的な活動の結果として周囲の空間に生じる電位(potential)が記録されたものである。fEPSPの最中に樹状突起から入った電流は細胞体付近から流れ出ることになる。それ故に、錐体細胞体層に置かれた記録電極では逆に、fEPSPは陽性(プラス)方向に記録される(陽性電位は「ソース(source)」と呼ばれる)。もし、このシナプス入力が活動電位を起こさせるほど強かったときには、細胞体層からの細胞外記録の電極では、活動電位に伴う細胞体への内向き電流によって、「集合スパイク(population spike)」と呼ばれる陰性電位が計測される(図9A上)。  図9 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 放線状層、細胞体層どちらから記録するときでも、fEPSPの立ち上がり相の傾き(slope)値が、シナプス活動の強さを測定する上で、信頼しうるパラメータとなる。一方、集合スパイクの大きさは、閾値に到達して発火した細胞のおおよその数を表すことになる。線維斉射の大きさは、電気刺激によって活性化されたシナプス前側の神経線維の数に比例する。場電位はvitro標本では数時間にわたって安定して記録できるため、海馬シナプス伝達の特性の解明に重要な役割を果たしてきた。 5-3 細胞内記録法 海馬には様々な種類の神経細胞があり、その電気生理学的な特性も様々である。歯状回果粒細胞とCA1錐体細胞は最高で数百Hzの高頻度で繰り返し発火することができる(Schwartzkroin, 1975, 1977)のに対し、CA3錐体細胞は5-10発の活動電位が一斉にバースト(burst)発火する傾向がある(Wong and Prince, 1987; Hablitz and Johnston, 1981)(図10)。CA3錐体細胞がバースト発火することは、KandelとSpencer(1961)がvivo記録で初めて見いだしており、てんかん様発作に関与すると考察されてきた(Kandel and Spencer, 1961, Traub and Llinas, 1979; Traub and Wang, 1981)。海馬神経のバースト発火にはいくつかの特徴がある。バースト中に活動電位の頻度が徐々に落ちる「適応(accommodation)」という現象や、また、バースト後にゆっくりとした「後過分極(AHP 、afterhyperpolarization)」が生じるのが特徴である。適応も後過分極も、バーストによるCa流入によってカリウムチャネルが活性化されることによって、部分的にであるが、説明がつく。  図10 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 求心線維刺激による応答を細胞内記録することで、図9Bに挙げたような興奮と抑制の連鎖が観察できる。細胞内記録は、鋭利な微小電極やホールセルパッチ電極を用いて行う。赤外線ビデオ顕微鏡を使うことで、脳切片標本にある個々の細胞を可視化できる(Stuart et al., 1993)ため、現在では、ホールセルパッチ記録法がもっともよく使われる。 人工刺激によって惹起されるEPSPの大きさは、小さいものでは1 mV以下であり、大きなものでは数10 mVに達する。一方、IPSPはだいたい1-10 mVであるが、必ずしもすべての細胞で起こるとは限らない。EPSPの上昇時間(10-90%振幅)は5 msのオーダーであり、もしIPSPが引き続かない場合は、その後、膜時定数(membrane time constant=およそ50 ms)に従って指数関数的に減衰する(Spruston and Johnston, 1992)。刺激によって惹起されるIPSPはEPSPよりもゆっくりと生じ、しばしば二つの成分からなっている。速い成分は20-50 msのピーク潜時で出現し、100-500 ms後に非指数関数的に減衰する。遅い成分は約100 msの潜時であり、減衰には1秒以上も要することさえある。樹状突起に観察されるIPSPは細胞体層にみられるIPSPよりも遅く、NMDA受容体の成分に似た時経過を示す。 刺激強度が十分に強ければ、EPSPは一つまたは複数の活動電位を生じる。活動電位は通常は、軸索起始部で生じ、軸索を下ってシナプス終末に到達するが、同時に細胞体や樹状突起にも伝播する。CA1錐体細胞の細胞体で活動電位を引き起こすのに必要な閾値は、静止膜電位を-65 mVとすると、そこから20-25 mV程度ほど脱分極された点にある。この閾値は固定値ではなく、膜電位がそれまでにどういう状態(prior history)にあったかによって変動しうる。たとえば、100 msec以上持続的に過分極すると閾値が下がる。また刺激のない状態でも、海馬神経細胞からは自発的なシナプス電位が記録される。これはシナプス前神経細胞のランダムな発火か、シナプス終末からの神経伝達物質の量子的放出によるものである(Brown et al., 1979; Brown and Johnston, 1984; Cossart et al., 2002)。 5-4 シナプス挙動にみる生理学的および生物物理学的な性質 シナプス伝達に関する基本的な仮説の多くは無脊椎動物の実験から立てられたものであり、そのほとんどは海馬神経細胞でも検証されている。伝達物質放出の量子仮説や、終末内Caイオンの役割などのシナプス末端の機構は、苔状線維やシャッファー側枝でも調べられている(Jonas et al., 1993; Stevens and Wang, 1994; Xiang et al., 1994; Bekkers and Stevens, 1995; Stricker et al., 1996; Johnston and Wu, 1995)。シナプス後側の機構については、シナプス電位におけるコンダクタンスの増減が海馬神経細胞でも調べられている(Barrionuevo et al., 1986; Magee and Cook, 2000)。抑制シナプスには興奮性シナプスと樹状突起で共存するタイプのものがあり、樹状突起上で生じるシナプス伝達の挙動は複雑である。 シナプス伝達に関する基本的な仕組みは以下のようである。まずシナプス前軸索に到達した活動電位が、シナプスボタンの中にCaイオンを流入させる。これがシナプス小胞からの神経伝達物質をシナプス間隙に放出させる。神経伝達物質はシナプス間隙を横断し、シナプス後膜にある特定の受容体に結合して、イオンチャネルを開口させる。単一のシナプス小胞によっておこる単位応答を「量子(quantum)」と呼ぶ。シナプスボタン一つあたり、少ないものでは一つの「シナプス接点(active zone)」しかない(シャッファー側枝など)が、多いものでは苔状線維の巨大シナプスのように37個もの接点を持つ(Chicurel and Harris, 1992)。極端な仮説としては、一つの接点から放出される小胞の数は(活動電位1発毎に)一つであり、しかも確率は高くなく、平均すると活動電位4発で1回でしか起きないのではないかという考え方がある(Korn and Faber, 1991; Allen and Stevens, 1994; Stevens and Wang, 1994)。ただし、最近では、複数の量子放出が起こることが、少なくとも苔状線維では確認されている(Henze et al., 2002)。 5-5 抑制性シナプス 全般に海馬の抑制性シナプスについてはあまり解っていないが、近年、急速に研究が進んできており、新しい情報も増えてきた(Lambert and Wilson, 1994; McMahon and Kauser, 1997; Ouardouz and Lacaille, 1997; Bartos et al., 2001; Bertrand and Lacaille, 2001; MacBain and Fisahn, 2001)。量子的な伝達をするという意味では抑制性と興奮性は類似しているが、抑制性シナプスでは複数の放出サイトがあり、高い放出確率を有している(Kraushaar and Jonas, 2000; Miles and Wong, 1984; Miles, 1990; Ropert et al., 1990)。また、抑制性神経は興奮性細胞よりも高頻度に発火できる点も重要なポイントである(Schwartzkroin and Mathers, 1978)。つまり、抑制性介在細胞への興奮性入力は、高頻度の活動電位を誘導するため、周辺の興奮性細胞はその後長い時間に渡って抑制を掛けられることになる。海馬介在細胞の発火パターンをいくつか図11に示した。  図11 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 6 神経伝達物質の受容体 6-1 興奮性の神経伝達物質 海馬の主要な興奮性伝達物質はグルタミン酸である(Storm-Mathison, 1977; Roberts et al., 1981)。グルタミン酸は貫通線維、苔状線維、交連連合線維、シャッファー側枝、および数種の興奮性介在細胞から放出される。グルタミン酸の作用点である受容体には大きく二つがある。イオンチャンネル共役型と代謝型である(Hicks et al., 1987)。イオンチャンネル共役型受容体は直接イオンチャネルを開閉するものである。一方、代謝型受容体は、Gタンパク質にカップルしており、それを通じて、イオンチャネルを開閉したり、セカンドメッセンジャー分子を活性化したりする。これらはそれぞれ、さらに大きな分子ファミリーに分けられる(Hollmann and Heineman, 1994)。イオンチャンネル共役型のグルタミン酸受容体には、AMPA受容体、カイニン酸(kainate)受容体、NMDA受容体がある。この名前は特異的に作用するリガンド名に由来している。AMPA受容体とカイニン酸受容体は速い成分のEPSPを担っており、NMDA受容体が引き起こすEPSPは遅い立ち上がりと遅い減衰が特徴である。これらの受容体分子はクローニングされている(Jonas and Monyer, 1999; Hollmann and Heineman, 1994)。AMPA受容体はGluR1からGluR4、カイニン酸受容体はGluR5からGluR7、KA1、KA2、そしてNMDA受容体はNMDAR1とNMDAR2A-Dというサブユニット(subunit)からなっている。一つの受容体は、4つのサブユニットがhomomericかheteromericな複合体を形成していると考えられている(Hollmann, 1999)。 AMPA、カイニン酸、NMDA受容体はさまざまな配合率で、海馬のすべての興奮性シナプスに存在しているが、その組み合わせの度合いは個々のシナプスで異なるようだ。たとえば、苔状線維シナプスではNMDA受容体はそれほど多く含まれていない(Monaghan et al., 1983)。また、シャッファー側枝には(とりわけ発達段階では)、NMDA受容体だけしか存在しないシナプス(「サイレントシナプス(silent synapse)」と呼ばれる)も存在する(Issac et al., 1995; Liao et al., 1995)。 代謝型受容体もまたグルタミン酸作動性のシナプスに存在する。こちらはシナプス前終末にも後側にも存在する(Shigemoto et al., 1997)。シナプス後側のものはイオンチャネル共役型受容体と共存しており、一方、シナプス前終末のものは神経伝達物質の放出を調節している(Schoepp and Conn, 1993)。代謝型受容体の分子サブユニットにはmGluR1からmGluR8までの8種があり、これらは大きく三つのグループ、つまり、Ⅰ型(mGluR1、mGluR5)、Ⅱ型(mGluR2、mGluR3)、Ⅲ型(mGluR4、mGluR6-8)に分けられる。この分類はアミノ酸配列の相同性、セカンドメッセンジャー系、作動薬の選択性によって分けられたものである(Conn and Pin, 1997)。Ⅰ型mGluRはホスホイノシチド回転を引き起こし、タンパクキナーゼCを活性化させる。Ⅱ型mGluRはアデニリルシクラーゼを不活性化し、cAMPの減少を引き起こす。Ⅲ型mGluRもまたアデニリルシクラーゼを阻害する。Ⅰ型受容体は主にシナプス後細胞に、Ⅱ型とⅢ型は前終末に発現している(Alagarsamy et al., 2001)。 イオンチャネル共役型のグルタミン受容体は、いずれも一価イオンであるNaイオン、Kイオンに対して非選択的な透過性をもったチャネルを持っている(Mayer and Westbrook, 1987)。NMDA受容体はまたCaイオン透過性も持っている(AMPA受容体やカイニン酸受容体にもCaを通すタイプのものがある)(Mac-Dermott et al., 1986)。NMDA受容体はCaイオンを透過するだけでなく、電位感受性があるという点でも独特である。静止膜電位の付近では、チャネルは細胞外のMgイオンによって阻害されるが、脱分極した状態ではその阻害が解除される(Mayer et al., 1984)。NMDA受容体はまたある型の長期シナプス可塑性の誘導に重要な働きをしている(Collingridge and Watkins, 1994)。 グルタミン酸応答のうちAMPA受容体成分はNMDA受容体にくらべて速い(図12)。AMPA受容体とNMDA受容体の両方を含むシナプスは速い成分と遅い成分が混合されているが、その度合いは膜電位とMg阻害によって変わってくる。  図12 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より もう一つの重要な興奮性神経伝達物質はアセチルコリンである。グルタミン酸と同じように、アセチルコリンもまた、イオンチャネル共役型と代謝型の受容体の両方に作用する。イオンチャネル共役型受容体はニコチン受容体であり、代謝型のものはムスカリン受容体と呼ばれる。ニコチン受容体はシナプス前終末に存在しており、興奮性シナプスにおけるグルタミン酸の放出を調節している(Gray et al., 1996; McGehee and Role, 1996; Mac-Dermott et al., 1999)。ニコチン受容体は抑制性介在細胞にも存在しており、抑制系の調節にも関与している。ムスカリン受容体は海馬ではシナプス前側にもシナプス後側も存在している(Williams and Johnston, 1993)。シナプス前終末では、グルタミン酸の放出を抑制する働きをしているため、抑制方向に作用していると考えられている。一方、シナプス後膜ではKイオンコンダクタンスを低下させる働きをしており(Brown and Adams, 1980; Brown et al., 1990; Storm, 1990)、膜電位を脱分極させ、活動電位を起こりやすくしている。ムスカリン受容体はまた、バースト発火のあとの後過分極も抑制する(Madison et al., 1987)。これらの作用は、神経細胞を脱分極させるだけでなく、Kコンダクタンス減少によって入力抵抗が高まり、興奮性入力がより発火を導きやすくするため、全体として興奮を高める方向に効いていることになる。 他にも多くの興奮性神経伝達物質が想定されているが(Frotscher et al., 1988)、それらの多くはGタンパクを通じて間接的に作用する代謝型である。ノルアドレナリン、ドパミン、セロトニンや多くのニューロペプチドがそれに相当するものの、Gタンパクを介しているため、その作用は神経細胞の状態に依存し、しばしば興奮性か抑制性かの判断が難しいことがある。この意味でも、こうした物質はより正確には「神経調節系(neuromodulatory)」として分類されるほうが良いかもしれない。 6-2 抑制性の神経伝達物質 海馬における主要な抑制性神経伝達物質はGABAである(Roberts et al., 1976)。脊髄やいくつかの脳部位ではグリシンが重要な抑制を担っているが、神経伝達物質という意味では海馬ではほとんど役割を担っていない。ただし、NMDA受容体の共作動薬として働いていてはいる(Johnston and Ascher, 1987)。 GABA受容体もまたイオンチャネル共役型と代謝型受容体に分けられる。イオンチャネル共役型の受容体はGABAA受容体と呼ばれ、この受容体にカップルしているチャネルはClイオンを通し、ピクロトキシン(picrotoxin)やビククリン(bicuculin)に感受性がある。ほとんどの海馬神経細胞のClイオンに対する「ネルンスト(Nernst)電位」は静止膜電位よりもマイナス側であるため、GABAAチャネルが開口すると、細胞は過分極する。また、GABAAチャネルの開口は、シナプス後細胞の入力抵抗を下げるため、同時にやってきた興奮性入力の効果を減弱させる。つまり、GABAのイオンチャネル共役型受容体への効果は、過分極と興奮の減弱であり、いずれも抑制性である。 代謝型のGABA受容体はGABAB受容体と呼ばれている。これはシナプス前終末とシナプス後膜に存在しており、Gタンパク質を介してKチャネルを開口させる(Dutar and Nicoll, 1988; Thalmann, 1988)。シナプス後細胞では、また、GABAB受容体は膜電位の過分極も惹起するが、この効果はGABAA受容体応答に比べると遅く、ゆっくりと始まり、ゆっくりと減衰する。シナプス前終末では、GABAB受容体は神経伝達物質の放出を減少させる。これはグルタミン酸作動性だけでなく、GABA性シナプスでも生じる。 かつては、抑制性シナプスは錐体細胞の細胞体に主に分布していると信じられていた(Andersen et al., 1964)が、今では、樹状突起全体に渡ってGABA性シナプスが存在するという証拠が数多く存在する。GABAB受容体は主に樹状突起に存在する(Miles et al., 1996)が、GABAA受容体は神経細胞全体に分布している。GABAA受容体とGABAB受容体が同じシナプスに共局在するかどうかはまだ解っていない。GABAA受容体とGABAB受容体は別々の介在細胞に由来しており、GABAB受容体は主にシナプスの接合部(active zone)の外に存在しているという説もある(Mody et al., 1994)。 海馬には、まだイオンチャネル共役型受容体に作用する抑制系の神経伝達物質がある。5-HTC受容体に作用するセロトニンである(Jackson and Yakel, 1995)。この受容体チャネルは陽イオンを非選択的に透過し、脱分極を引き起こすが、多くは介在細胞に存在しているので、回路全体としてみれば抑制に働くことになる。ほかにも抑制系と考えられるシナプス前側/後側に作用する神経調節系の物質がいくつか存在する。ドパミンや(5-HTC受容体以外に作用する)セロトニンや、ニューロペプチドなどである(Frotscher et al., 1988)。 6-3 部位別考察 ─ 貫通線維 すでに述べたように、貫通線維は、嗅内皮質のどこから来るか、どこに投射するかによって、大きく二つのグループ、外側貫通線維と内側貫通線維に分けられる(Steward, 1976; Yeckel and Berger, 1990, 1995)。両者ともグルタミン酸作動性のEPSPを、果粒細胞の樹状突起に生じさせが、外側貫通線維は高頻度に発火したときにはオピオイドペプチドも放出することが知られている(Gall et al., 1981)。オピオイドは外側貫通線維の長期増強(LTP)に関与することが知られている(Bramham et al., 1988; Brindel et al., 1994; Xie and Lewis, 1995)。 6-4 部位別考察 ─ 歯状回門線維 歯状回門についてはあまり解明がすすんでいないが、抑制性の介在細胞や籠細胞が存在し、フィードフォワードおよびフィードバック抑制を果粒細胞に掛けている。苔状細胞(Scharfman and Schwartzkroin, 1988)は、苔状線維から興奮性の入力を受け取っていて、果粒細胞に興奮性フィードバックを掛けている(Scharfman, 1995; Scharfman, 1996)。この経路の機能的な意義は不明であるが、ある種のてんかんの発生に関与しているようだ(Scharfman, 1994)。 6-5 部位別考察 ─ 苔状線維 苔状線維のシナプスボタンは、蝸牛神経核(Cochlear nucleus)に存在する巨大シナプスを除けば、哺乳類の中枢神経系ではもっとも大きなシナプスに属する。各ボタンには最大37個のシナプス接点が存在し、神経伝達物質の多重放出が行えるようになっているChicurel and Harris, 1992)。シナプスボタンには高濃度のZnイオンとオピオイドが含まれており、主要神経伝達物質であるグルタミン酸とともに放出される(Stengaard-Pedersem et al., 1981; Howell et al., 1984; Aniksztejn et al., 1987)。ほとんどのペプチドと同じく、オピオイドも高頻度の刺激の時のみグルタミン酸と放出される(McGinty et al., 1983; Hokfelt et al., 1989)。また苔状線維はGABAを共放出することも示唆されている(Walker et al., 2001)。すでに述べたように、苔状線維はCA3錐体細胞の近位樹状突起にシナプスを作っているが、この近位という場所はきわめて重要で、機能的なインパクトは大きい。 こうした変わった特徴を持ち合わせているにも拘わらず、苔状線維のシナプス伝達は多くの点でオーソドックスである。苔状線維の活動はCA3錐体細胞に速いグルタミン酸性EPSPを惹起する。ただし、放出サイトが多重であるため、苔状線維一本が生じるEPSPの大きさは、シャッファー側枝に比べて大きいし、近位投射であるため、樹状突起フィルターによる減衰をあまり受けない。それ故に、CA3錐体細胞を発火させるために必要な入力数は少なくてすむ。Znイオンやオピオイド(もしくはGABA)を共放出する意味はあまり分かっていないが、オピオイドは苔状線維シナプスのLTPの導入に何らかの役割をしているかもしれない(Derrick and Martinez, 1996; Williams and Johnston, 1996)。 苔状線維が近位樹状突起にシナプスを作っていることは実験者の立場にも利点がある。それは、細胞体を電位固定することで、シナプス直下の膜電位をコントロールすることが、遠い樹状突起枝のシナプスに比べれば、ずいぶんと容易だという点である(Johnston and Brownm 1983)。それ故に、苔状線維シナプスの電流やコンダクタンスについてはかなり詳しく調べられている。苔状線維のシナプスコンダクタンスの最小単位はおよそ1 μSであり、量子コンダクタンスは100-200 nSである。つまり、個々のボタンは通常、5-10量子を放出していることが逆算できる。電位固定(voltage-clamp)下では、量子応答は1 ms以内に立ち上がり、時定数約5 msで減衰する。この値は、グルタミン酸チャネルの速度と類似しており、逆にこの事実は、正確な電位固定実験が遂行されていたことを示している。 苔状線維のシナプスは巨大であるため、シナプス末端からのパッチ記録やCaイメージングが可能となる(Geiger and Jonas, 2000; Bischofberger et al., 2002; Liand et al., 2002; Regehr et al., 1994)。Jonasらはボタンに存在するCaイオンやその他のチャネルのタイプを明らかにし、また、活動電位の形が活動依存的に変わり、神経伝達物質の放出が変調されることを見いだした(Bischofberger et al., 2002)。CaチャネルからのCa流入だけでなく、細胞内ストアからのCa放出の経路もあるようだ(Liang et al., 2002)。 苔状線維の走行する透明層には介在細胞も存在しており(Spruston et al., 1997)、苔状線維からシナプス入力を受けている。介在細胞へのシナプス入力にはスパイン性のものと非スパイン性のものの、二つのタイプがある。非スパイン性のものはGABA性であり、錐体細胞へのフィードフォワードの抑制を掛けているようだ。スパイン性のものは、これとは別のタイプの介在細胞でグルタミン酸作動性であり、フィードフォワード性興奮を司っている。 6-6 部位別考察 ─ CA3再帰回路 CA3野の特徴の一つは、錐体細胞同士が強く相互に連結しあっていることである(MacVicar and Dudek, 1980; Miles and Wong, 1986)。この再帰経路は、グルタミン酸作動性であるため、CA3回路はフィードバック興奮経路を含んでいることになる。必然的にCA3回路の挙動は不安定になる。そもそも、CA3錐体細胞自体はバースト発火を引き起こしやすいこともあり、わずかでも興奮抑制比が崩れると、CA3回路はてんかん様発火を発する。このてんかん様発火は、かなりの数の神経細胞が同時発火し、自発的に生じるが、リズムは定期的である(Traub and Miles, 1991)。CA3のてんかん様発火は、CA1やその先の脳領域にまで広がっていく。実際、てんかんの多くタイプでは、CA3野のように再帰回路を含む領域で、興奮と抑制のバランスが崩壊することから生じると信じられている。 CA3再帰回路はまた「鋭波(sharp wave)」を生み出す部位でもある。これは少数のCA3錐体細胞グループが同期したバースト発火を起こすことによって惹起されると考えられている。この鋭波は、覚醒しながら安静している時、もしくは「徐波睡眠(slow-wave sleep)」の時に観察され、記憶形成に関係していると見られる(Buzsaki et al., 1989)。実際、再帰回路は連合記憶を可能にする基本構造であるといわれている(Kohonen, 1978)。この「パターンコンプリーション仮説」は、CA3錐体細胞のみでNMDA受容体遺伝子を除去したマウスによって、ごく最近、直接証明された。このマウスは、仮説から予測されるように、きわめて特定の記憶(つまり連合記憶)だけが障害を受けていた(Nakazawa et al., 2002)。 6-7 部位別考察 ─ シャッファー側枝 シャッファー側枝は海馬の中ではもっともよく研究が進んでいる回路である。多種多様なタイプのシナプス可塑性を起こすのが研究者たちの興味を引いているからだ。シャッファー側枝一本は、数千ものCA1錐体細胞に投射しており、通常は標的細胞あたり一つか二つ程度のシナプス結合しか形成していない(Sorra and Harris, 1993)。放線状層でシャッファー側枝を電気刺激すると、標的細胞に興奮と抑制のシナプス応答が順次観察される。CA1錐体細胞はまた、CA1錐体細胞と再帰的な回路を作ってはいるが(Radpour and Thomson, 1991)、その密度はCA3野に比べれば、きわめて疎で弱いものである。 7.海馬のシナプス可塑性 シナプス可塑性の一般的な定義は、シナプスの以前の活動に応じて、シナプス応答の大きさが変動することである。海馬の興奮性シナプスの多くは、様々なタイプの活動依存的なシナプス可塑性を示す。可塑性は、持続時間や時間経過などで、細かく分類される。以下、各々を見ていこう。 7-1 短期可塑性 短期可塑性は、持続時間が数百msから数分のものを指し、促通(facilitation)、テタヌス後増強(post-tetanic potentiation)、抑圧(depression)がある。 7-2 短期可塑性-促通 促通がはじめて発見されたのは、カエルの神経筋接合部であるが(del Castillo and Katz, 1954)、より詳しく研究されたのは、運動神経や海馬においてである(McNaughton, 1982; Deanne et al., 1996; Dittman et al., 2000;Kim and Alger, 2001)。より一般的な形としては、PPF(Paired-pulse facilitation)と呼ばれる現象がある。PPFは刺激を2発組み合わせて同じシナプス経路に与え、一つ目のEPSPと二つ目のEPSPを比較することで評価される(Schulez et al., 1994; Lim and Alger, 2001)。PPFの大きさは刺激の間隔によって変わる。50 msくらいの間隔の場合、EPSPは数百%にも増大されることがあるが、間隔が伸びるとPPFは減少していく。この減少はほぼ指数関数的減衰であり、時定数は100-200 ms程度である。 7-3 短期可塑性-テタヌス後増強 PTPは連発刺激(train of stimuli)に引き続いて起こるシナプス応答の一過性の増大である。増強は刺激直後には数百%に達することもあり、この増強は数100 msを掛けて減衰する。PTPには2つの成分があり。一つは5-10 secの減衰定数を持つ「増幅(augmentation)」と呼ばれる相であり、もう一つはもっと遅い減衰を示す、いわゆるPTPと呼ばれる相である(Johnson and Wu, 1995)。PPFとこれら二つのPTPの相は、いずれもシナプス前末端内のCaイオン濃度が上昇することで、神経伝達物質の放出確率が増大することによって生じる。いずれもシナプス可塑性の重要な型であり、刺激毎、もしくは標本毎にあまりばらつかないという特徴をもつ。 7-4 短期可塑性-抑圧 シナプス応答の「抑圧」にも多くの型がある。シナプスが繰り返し刺激されると、シナプス前部終末から放出可能な小胞のプール(readily releasable pool)が枯渇することで、短期抑圧が生じうるが、こうした抑圧の時間経過は、放出される神経伝達物質の量に応じて、数百msから数分と様々である。もっと短時間(10 ms以下)で生じる抑圧もある。これは神経伝達物質が結合することで受容体が脱感作することによるシナプス後膜の機構で生じるものである(Stevens and Wang, 1995; Wang and Kelly, 1996)。 7-5 長期可塑性 海馬のグルタミン酸作動性の興奮性シナプスには30分から数時間にわたって持続する長時間タイプのものも存在する。これは、シナプスを連発刺激するか、もしくはシナプス前細胞と後細胞を特定の時間パターンで刺激することで誘導される。まとめて、長期増強(LTP、long-term potentiation)や長期抑圧(LTD、long-term depression)などと呼ばれるが、そこには、いくつかの異なった分子メカニズムが含まれている。 7-6 長期可塑性-長期増強 LTPはBlissらのよって発見された(Bliss and Gardner-Medwin, 1973; Bliss and Lomo, 1973)。LTPはおそらくもっとも盛んに研究されているシナプス可塑性であるが、その理由は記憶・学習への関与が示唆されているからであろう(Bliss and Collingridge, 1993; Malenka and Nicoll, 1999; Bennett, 2000; Martine et al., 2000)。LTPのメカニズムはまだまだ熱い議論が交わされており、とても確定されたとは言えない。しかし、コンセンスが得られている事実もある。 LTPは25-200 Hzといった高頻度の連発刺激を、貫通線維、苔状線維や、シャッファー側枝などのシナプス経路に与えることで誘導される。高頻度刺激の時間帯をLTPの「誘導相(induction phase)」と呼ぶ。誘導相のあとの時間帯を「発現相(expression phase)」と呼び、ここではテスト刺激への応答は、高頻度刺激前より50-200%ほど増強している。発現相が誘導相よりも長いことがLTPの特徴である。通常、誘導相は数秒から1分程度あるが、発現相は数日に及びうる。発現相がどこまで持続しうるかを調べるのは難しいが、LTPが永遠に続くということはないだろう。 もっと短い繰り返し刺激でもLTPを引き起こすことが可能である。無麻酔の覚醒動物の海馬は、シータ(theta)と呼ばれる5-10 Hz帯のリズムを持った脳波(EEG)が観察される。シータバースト刺激(theta burst stimulation)は、このシータリズム(通常5 Hz)で短い連発刺激を繰り返すような刺激パターンであるが、この刺激はLTPを効率よく誘導することができる(Magee and Johnston, 1997; Thomas et al., 1998)(図13)。とりわけ、シナプス前線維とシナプス後細胞の両者を同時にシータ周期で連回刺激する方法(pairing)は、theta burst pairingと呼ばれ、さらに効率よくLTPを誘導できる。シータ周期の神経活動は実際に行動中の動物脳で観察されるので、こうしたパターン刺激は単なる高頻度刺激よりも生理的だと考えられている。 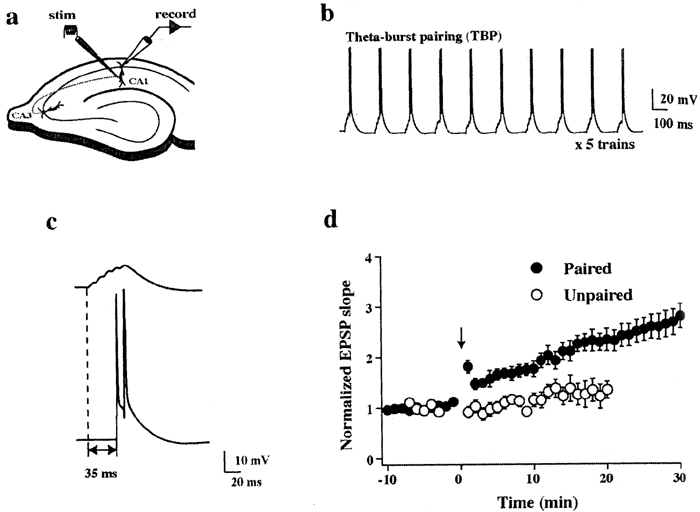 図13 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より 最近の研究では、シナプス前細胞と後細胞のそれぞれ一発の活動電位を組み合わせた刺激を連続して与えることでLTPやLTDを誘導することができることが明らかになった。LTPかLTDかのどちらが生じるかは活動電位のタイミングによって決まる(図14)。たとえば、シナプス後細胞の活動電位がシナプス前細胞よりも0-100 msだけ前に発生するとLTDを生じるし、逆に0-20 msほど後に発生するとLTPになる。このプロトコールはスパイクタイミング依存性可塑性(STDP、spike timing dependent plasticity)と呼ばれている(Bi and Poo, 2001)。 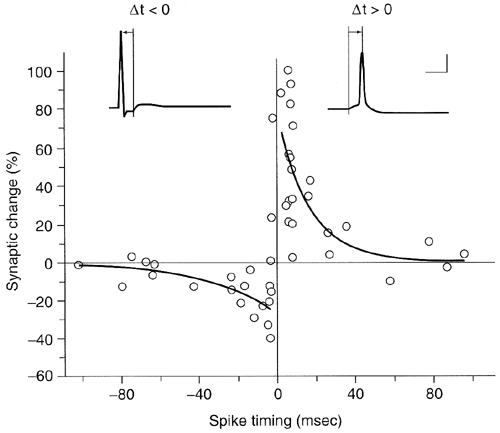 図14 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より LTPの重要な性質として、入力のあったシナプスに特異的に発生するというものがある(Hoffman et al., 2002)。言い換えれば、シナプス応答の変化が起こるのは、高頻度刺激やシータ刺激を受けたシナプスだけということである。またLTPには連合性(associative property)という特徴がある。これは、そのシナプスと同時に他のシナプスも活動したら、LTPが生じるという現象である。LTPはこうした特徴を併せ持つからこそ、記憶機構の候補として研究者の興味を惹きつけているのである(Bliss and Lynch, 1988; Madison et al., 1991; Teyler et al., 1994; Brown et al., 2002)。 7-7 長期可塑性-長期抑圧 LTPの裏返しがLTDである。LTDはシナプス応答が長期的に抑圧される現象である(Dudek and Bear, 1992; Mulkey and Malenka, 1992; Bear and Abraham, 1996; Christie et al., 1994;, 1996; Goda and Stevens, 1996)。LTDは1-5 Hz程度の低頻度の刺激を何分にもわたって繰り返すこと誘導されるが、上に述べたSTDPのパラダイムによっても誘導可能である。LTDの発現相も30分から数時間に渡って継続する。似たような現象として、LTPを起こしたシナプスに低頻度刺激を与えると、増強分が元に戻る「脱増強(depotentiation)」という現象も知られているが、これはおそらくLTDとは異なる機構によって生じるものである。多くの数理研究のモデルでは、特定のシナプス経路を増強させるために、他のシナプスを弱めることで学習を成立させている。つまり、LTD様の現象はずいぶんと昔から論理的には使われてきていたわけである。 多くのシナプスにおいて、LTPとLTDの形成にはNMDA受容体の活動が深く関与している。LTPの誘導には刺激されたシナプス付近で細胞内Caイオン濃度が上昇することが必須である。これはNMDA受容体やCaチャネルを通じてCaイオンが流入することでもたらされる(Johnston et al., 1992; Teyler et al., 1994; Morgan and Teyler, 1999)。苔状線維のシナプスは、その他のシナプスとは異なり、LTPはNMDA受容体には依存していない。いくつかの実験的な理由から、苔状線維のシナプス可塑性は研究がしにくく、その機構についてもまだ一致した見解が得られていない部分もある(Nicoll and Malenka, 1995; Yeckel et al., 1999)。 8.海馬機能への考察 8-1 海馬と記憶・学習 海馬の機能に関するもっともよく知られていて、かつ今でも有効な説は、記憶との関係であろう(Eichenbaum, 1994, 2000; Milner et al., 1998)。ある脳部位が損傷されると、非可逆的に完全な(あるいは重度の)順向性健忘が生じることは、もう百年近く前から知られている。こうした患者は、毎日の生活で起こった物事の記憶を呼び起こすことができない。現在では、海馬の損傷のみで、こうした健忘が引き起こされることが解っている。 もっともよく知られた例は、すでに述べた、HMという男性患者である。彼は若い頃、生命が危ぶまれるほどのひどいてんかんを煩っていた。1953年、HMは両半球の海馬体とその周辺の脳部位を切除する手術を受けた。この手術はてんかん発作が軽減したものの、劇的な副作用が現れた。彼は手術後から(現在に至るまで!)、新しい情報を長いあいだ保持しておくことができなくなった。それ以外の点においては、彼の精神状態はおおむね正常であった。 その後も、両側の海馬に損傷がある患者の例が続々と報告された。1986年、患者RBの症例が、Zola-Morganeら(1986)によって報告された。RBは冠動脈バイパス手術の最中、脳虚血に陥った。事故発生から5年後にRBは神経心理学的な試験を受けた。HMの場合と同じように、RBは顕著な順向性の記憶障害を生じたが、手術前の記憶に関しては、ほとんど、あるいはまったく記憶障害が見られなかった。RBの死後、脳を解剖したところ、記憶障害に関係していそうな病理的な変異は、海馬CA1野の錐体細胞の完全な脱落のみであった。RBの健忘はHMよりも症状が軽かったので、記憶障害の程度は、海馬体や周辺の皮質がどの程度の範囲まで損傷を受けたかに依存していると考えられる。いずれにしても、海馬に限局された脳障害のみで、臨床上ひどい健忘症を引き起こすのに十分であることは明らかである。 動物モデルで記憶を評価する試験法は、ヒトの試験法とはずいぶんと本質的に異なっているが、海馬体の破壊でヒトと類似した記憶障害が生じることが知られている。空間記憶を評価する試験としてよく使用されるものにモリスの水迷路(Morris water maze)がある。この試験では、ラットを乳白色の水を満たした小さなプールにいれて強制的に泳がせる。プールには動物からは見えないように小さなプラットホームを沈めておく。このプラットホームは動物が水泳から回避できるための浅瀬となっている。ラットは試験を繰り返すうちに、実験室の風景の手がかりにプラットホームがどこにあるかを学習していく。そして、水泳開始点からプラットホームへ到達する時間はどんどんと短縮されていく。海馬を破壊された動物では、この試験の成績が劇的に低下する。実質上まったくプラットホームの位置を覚えることができなくなる。 海馬の記憶機能を探求している研究者たちが最近好んで使用するようになった試験は他に、恐怖条件付け文脈学習(contextual fear conditioning paradigm)や、DNMS(delayed non-match to sample)や空間交替Y字迷路(spatial alternation T-maze)などがある(Eichenbaum, 2000)。恐怖条件付け文脈学習は古典的なパブロフ型の条件づけパラダイムであり、動物は状況や環境を嫌悪ショックに結びつけることを学習する。この試験はシンプルな実験系で、データに悪影響を与える行動変数が少ない(たとえば、水迷路では水泳能力や水泳へのモチベーションが試験結果に影響を与えてしまう)。DNMSは、特定の物体や臭いを様々な期間、動物に覚えさせる試験であり、ヒトを含む様々な種に対して有用に活用されている。Y字迷路は、動物を左右の枝分かれ道を選ばせて順番の記憶を評価する試験である。これらの試験はいずれも海馬依存性の試験であり、とりわけDNMSとY字迷路試験は、海馬が“イベントの順番”を記憶するのに重要な部位であることを証明するのに使われた(Lisman, 1999; Fortin et al., 2002)。 電気生理学的実験によって、海馬の神経細胞が環境内に置かれた何らかの刺激によって活性化されることが示された。たとえば、迷路内を走り回るラットの個々の海馬神経細胞の活動を記録すると、特定の細胞は迷路の特定の場所を走り抜けるときに活動することが分かる。これは場所細胞(Place cell)と呼ばれる海馬の細胞である。こうしたデータから、外の世界を認識する地図(cognitive map)が海馬の中に形成されているものと推測されている(O’Keefe, 1979)。より一般的な意味では、海馬体の神経細胞は、様々に活性化されるユニットの組み合わせ、つまり「アセンブリー(assembly)」として働くことで、現在の経験を内部表象している、と考えることもできる。おそらく、こうした海馬の内部表象と、大脳皮質にあるより詳細な経験情報が相互作用することによって、長期的な記憶が形成されるのだろう(Wilson and McNaughton, 1993, 1994; McHugh et al., 1996)。これらの電気生理学的なデータが示唆することは、海馬体の神経細胞がある特定の情報に選択的に反応するわけではなく、むしろ、行動のすべてを表す内象を一時的に記憶しておく、いわば、短期記憶バッファーとして働いていると考察される。この内部表象が後に再生されることで、ゆっくりと大脳皮質の長期的な記憶に置き換えられていくのだろう(Eichenbaum, 2001; Haist et al., 2001)。実際、徐波睡眠(slow-wave sleep)中に海馬で、覚醒時での行動が内部再生されることはすでに示唆されている(Hoffmann and McNaughton, 2002)。 海馬は非常に特徴的な電場の揺らぎ活動を示すが、これが記憶・学習に関与している可能性がある。動物が環境を探索するときには、5-10 Hz(シータ)周期の脳波(EEG)が記録される(O’Keefe, 1979; Buzsaki, 1989, 2002)。探索をやめ、静かにしているときは、シータの代わりに、大きな振幅で不規則に生じる「鋭波(sharp wave)」が記録される。これら二つのタイプの脳波は、相互に排他的であって、同時には生じない。シータ波を出しているときには、海馬は環境の新しい内部表象を獲得しており(Huerta et al., 2000; Mehta et al., 2000)、一方、鋭波を出しているとき(または徐波睡眠中)には、海馬は皮質への記憶の固定を促進していると考える説もある(Sutherland and McNaughton, 2000; Jarosiewicz et al., 2002)。 8-2 海馬と疾患 海馬は、てんかんやアルツハイマー病や統合失調症(schizophrenia)など、さまざまな神経精神疾患に関与すると考えられている。冒頭で述べたように、海馬は脳の中でもっとも発作閾値が低い。てんかん動物モデルでは、発作に関連する電気活動の多くが、vivo、vitroを問わず、海馬から記録される(Traub et al., 1989)(図15)。こうして記録されるてんかん様活動は、定期的に生じる高度な同期活動が特徴であり、しばしばCA2やCA3野から開始される(Johnston and Brown, 1981, 1984, 1986)。海馬がてんかん様活動を起こしやすいのは、錐体細胞同士が興奮性の再帰回路を形成しているからであり、とりわけCA3錐体細胞はそれ自体でもバースト発火をしめす傾向がある。正常な状態では、様々なGABA性介在細胞が強い抑制を掛けており、異常発火が生じるのを防いでいる。しかし、神経細胞の発火特性や、抑制と興奮のバランスが微妙に変化すると過剰興奮が伝播し、発作へとつながる。 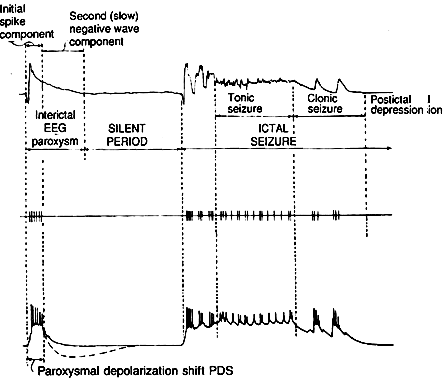 図15 The Synaptic Organization of the Brain, Ed: Gordon M. Shepherd, Oxford University Press (2003)より アルツハイマー病の初期の症候は新しい記憶の獲得能力が欠如することである。最終的には古い記憶も薄れたり消えたりする。海馬は記憶・学習に重要であることを考えれば、アルツハイマー病で海馬がひどく障害を受けていたとしても、それほど驚くべきことではない。実際、アルツハイマー病では、海馬は脳の他の領域からの結合がとぎれ、隔離されてしまうことが示唆されている(Hyman et al., 1984)。また、アルツハイマー性の病理が最初に現れるのが嗅内皮質である。海馬以外の脳部位も影響を受けるだろうが、これによって、情報を処理する能力が劇的に奪われてしまうのは、なによりも海馬であろう。 海馬はまた虚血や無酸素症に脆弱である。こうした悪条件下で神経細胞死が生じる脳部位はそれほど多くないが、海馬はまさにそうした部位である。細胞脱落はNMDA受容体を介した興奮毒性(excitotoxicity)によるものだと考えられている。このように海馬はかなり不安定な脳部位であり、また多くの代謝的なストレスに見舞われやすいのだが、これは海馬が新しい情報をどの脳領域よりも素早くコード化できるために海馬が払った代償であると考えることもできる。 統合失調症と海馬の関係はあまりはっきりしないが、統合失調症患者では海馬の大きさが有意に小さく、形態学的にも異常が観察されるという所見は重要である(Luchins, 1990)。しかし、どうしてこうした異常が統合失調症に特徴的な幻覚や精神異常を引き起こすのかはまだ謎である。 * この文章は『The Synaptic Organization of the Brain』(Gordon M. Shepherd編集、Oxford University Press;、第5版、2003年)の第11章「Hippocampus」(Daniel Johnson、David G. Amaral著)を部分的に翻訳した文章であり、一部追記したり、誤表記を訂正したりしています。木村梨絵さんと小山隆太君に協力いただきましたことをお礼申し上げます。なお、訳文掲載の旨はOxford University Press社に連絡済です。 |