| 海馬苔状線維とは 苔状線維(mossy fiber)は、海馬CA3野および歯状回門(dentate hilus)に投射する歯状回顆粒細胞の軸索である(図1)[1,2]。1886年Golgiによってはじめてその存在が記載され、その7年後にRamon y Cajalにより「苔状線維」と命名された。この呼称はゴルジ染色像が小脳の苔状線維のものと類似していたことに由来している。海馬体の神経連絡で最初に投射が解明された神経組織である。 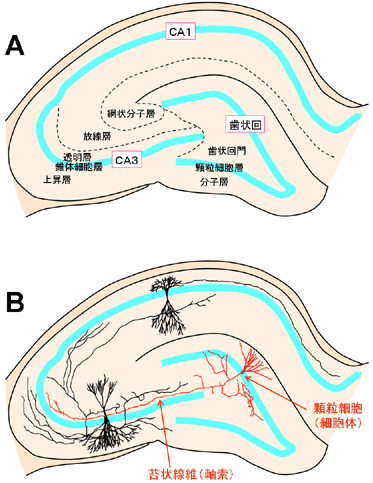 図1 海馬と苔状線維の概略図 A:海馬体の微細構造と各部位の名称、B:顆粒細胞と苔状線維の投射パターン。苔状線維は明瞭層内をCA3野に向かって投射する。 苔状線維はミエリンを持たない無髄軸索であり高密度に束化している(図2A)。線維の直径は約1 μm(図2A)。神経伝達物質は主にグルタミン酸などの興奮性アミノ酸だが、抑制性アミノ酸であるGABAも放出することが近年示唆されている[3,4]。苔状線維は通常、海馬体の長軸に垂直な平面内でCA3野内を層状に走行し、CA2野の境界で急旋回し、海馬体の長軸方向に向きを変える[5]。ラットにおける走行全長はおよそ3 mmである[6]。 苔状線維は歯状回門とCA3野に存在する神経細胞とシナプスを作る。苔状線維一本あたり約220個のシナプスが存在している、投射先の約90%は抑制性神経細胞である[7]。歯状回門では約150個のシナプスを形成している。そのうち約10個が苔状細胞と呼ばれる大型の介在性興奮性神経細胞であり、残りの投射先はすべて抑制性の神経細胞である。一方、CA3野内では、苔状線維一本あたり約70個のシナプスが存在し、そのうち約14個は錐体細胞へのen passant様出力であり、いわゆる海馬の「主要三シナプス回路(trisynaptic pathway)」の一部分を形成している[8]。このシナプスは錐体細胞の先端樹状突起の最近位に分布し、同部位は光学顕微鏡下で白色に透過して見えるため「透明層(stratum lucidum)」と呼ばれている[8]。また、錐体細胞からみれば一個あたり約50個の苔状線維シナプスからの入力を受けている[9]。 苔状線維は歯状回から海馬へ入力する唯一の興奮性線維である[10,11]。ラット脳において、顆粒細胞は約100万個、CA3野錐体細胞は約30万個存在しており[9]、細胞数の比から考え、歯状回→CA3野のネットワークで、神経情報の圧縮または抽出が行われていることは間違いないであろう。苔状線維の投射先の大多数が抑制性であることを考慮すると[7]、顆粒細胞の活動はごく少数(14個程度)の錐体細胞を活性化して、残りの大多数を抑制すると思われる。さらに苔状線維の入力がCA3野錐体細胞にカオス発火を惹起することを考慮すると[12]、苔状線維の信号入力によってCA3野の自己連合回路に機能的アトラクタが構築されることも想定される。  図2 苔状線維の特徴 A:マウス海馬CA3野明瞭層の横断面(透過型電子顕微鏡像)。多数の苔状線維の断面が見える。線維は相互に束化している。B:DiI染色された苔状線維の巨大シナプスの共焦点レーザー顕微鏡像。シナプス膨潤(varicosity)には複数の糸状仮足(filopodia)があり、複雑な形態をしている。C:苔状線維の巨大シナプスの電子顕微鏡像。小型のシナプス小胞が充填されている。D:海馬新鮮凍結切片(冠状断)のTimm染色像。苔状線維シナプスが黒色のシグナルとして、透明層および歯状回門に検出されている。 海馬苔状線維の主な特徴 苔状線維とそのCA3野錐体細胞へのシナプスは、他の中枢神経系組織とは大きく異なる興味深い性質を数多く持ち合わせている。以下にその数例を挙げる。 1)苔状線維はCA3野錐体細胞と巨大シナプスを形成する(図2B)。その直径は通常4 μm以上であり、大きいものでは10 μmにも達する[13,14]。苔状線維が起始する顆粒細胞の直径が約10 μmであることを考えれば[8]、同シナプスがいかに大きいかを理解できる。個々の巨大シナプスは、平均8個のミトコンドリアと、数千個ものシナプス小胞を含んでいる(図2C)[13,15]。なお、シナプス小胞は直径40 nmと一般のものにくらべ小さい(図2C)。また、一つの終末には複数のシナプス活性領域(active zone)が存在し、多いものでは30個を越える[7,16]。これに伴いシナプス後側スパインもまた巨大かつ複雑な形態をとり、これは棘状瘤(thorny excrescence)と呼ばれている[13,16]。シナプスボタンは、シナプス前後膜の裏打ち構造が共に肥厚した対称性シナプス(puncta adhaerentina)である[14]。 2)苔状線維のシナプス電位は顕著なfrequency facilitationを生じる[17]。短い間隔で苔状線維を繰りかえし刺激すると、一回目の刺激より二回目の以降の刺激によって放出される伝達物質の量が劇的に増える。標的錐体細胞で記録されるシナプス後電位は、頻回刺激に伴い数倍の増強率を示す。一般的なシナプスのほとんどが1.5倍以下の増強率しか示さないことを考慮すれば、この特性は極めて例外的であるといえる。 3)苔状線維シナプス前終末にはグループII代謝型グルタミン受容体が豊富に発現し、環状AMPシグナル系の抑制を介して神経伝達物質の放出を恒常的に抑圧している[18]。2)と3)の両特徴は電気生理学的解析を行う上で、苔状繊維のシナプス電位を同定するためにしばしば利用される。 4)苔状線維の無髄線維上にカイニン酸受容体が発現している[19]。苔状線維シナプス前終末に存在するカイニン酸受容体は神経伝達物質放出の促進に関与すると考えられているが[20,21]、この受容体はシナプス前終末だけでなく、シナプス以外の軸索上にも存在しており[21]、おそらくシナプスから漏出したグルタミン酸を感知しているものと思われる。軸索上に存在するカイニン酸受容体は、細胞体の発火とは独立して発火を誘導できる可能性も指摘されており[22]、苔状線維のカイニン酸受容体は海馬CA3野の演算機構を考える上で一つの鍵を握っているかもしれない。 5)苔状線維シナプス終末にZnイオンを豊富に含有する[23]。このZnイオンはシナプス小胞中にグルタミン酸と共に存在し、神経活動に伴いグルタミン酸と共に放出される[24,25]。したがって、我々は苔状線維のシナプスを「バイリンガルシナプス」と名付けた[26]。Znイオンは苔状線維終末に含まれる神経伝達物質や神経ペプチドまたはそれらの受容体と相互作用することで、神経細胞の興奮性を調節していると考えられている。近年我々は、放出されたZnイオンが苔状繊維シナプスから漏出し、近隣のCA3野神経回路のNMDA受容体を抑制することを示した[26]。また、Znイオンは苔状線維の形成や機能維持にも寄与する可能性が示唆されているが、小胞ZnイオントランスポータであるZnT3の欠損マウスにおいても苔状線維の形態には目立った影響がないことから[27]、神経細胞の興奮性調節がZnイオンの主要な役割であろうと考えられる。一方、Znイオンを豊富に含有するという性質を利用して苔状線維を選択的に染色するTimm法は[28]、簡便かつ有用な実験手技として幅広く利用され、苔状線維の研究に多大な貢献をしている。図2Dに典型的なTimm染色像を示した。苔状線維シナプスが分布する歯状回門と透明層の両領域が、銀イオンの還元反応により黒色に染色されているのが見て取れる。 6)苔状線維は生後に形成され、生涯に渡って付加され続ける[29,30]。歯状回顆粒細胞の発生が胎生後期に始まり生後早期にまで渡るため、それに伴い軸索である苔状線維の発達も生後に行われる。齧歯類の苔状線維の形成時期は、主に生後第2-3週目である[31]。ヒトの場合は詳しく研究されていないが、生後2年程度は海馬の発達が持続するという報告例からも、乳児期から幼児期にかけての期間が主な苔状線維の形成時期に相当するものと考えられる。また、顆粒細胞の新生は成熟後の脳でも継続しており[29,30]、苔状線維は量的な変化を介した可塑性を示す珍しい神経組織である。同線維にこのような特殊な性質が与えられている理由は不明だが、顆粒細胞の新生がある種の学習に関与している可能性が近年示唆されている[32]。新生した顆粒細胞は通常の神経機能を獲得するが[33]、その後の運命はわかっていない。嗅球の顆粒細胞のように「細胞交替」が生じているかも厳密には未だ証明されておらず、また仮に交替が生じていたとしても[34]、全体のどのくらいの割合の細胞が交替するのかは不明である[35]。 7)苔状線維は、記憶・学習への関与が示唆される海馬神経ネットワークを形成する8。神経毒コルヒチンをラットに体性投与すると歯状回顆粒細胞を選択的に脱落させることができる。このラットは海馬依存性の空間学習課題の遂行能力が低下している[36]。したがって、苔状線維から海馬への情報入力がこの種の学習には必須である。一方、コルヒチン処置ラットでも、海馬の場所細胞(place cell)の活動は正常に保たれていることから、空間認知の内部表象に関与する情報は苔状線維による入力を必要としないと考えられる。 8)苔状線維シナプスの長期増強現象(long-term potentiation, LTP)の形成機構が特殊である[37]。特定のパターン刺激に応じて神経伝達効率が長期的に亢進する現象であるLTPは、記憶、学習の基礎をなすシナプス可塑性の一例として盛んに研究されている[38]。苔状線維のLTPの形成機構は、一般的なシナプスのLTPの機構と比較し極めて特殊である。一般的なLTPの形成機構としては、脱分極で活性化されたシナプス後膜のNMDA受容体[39,40]を通じCaイオンが流入し[41-43]、これがCa/カルモジュリン依存性キナーゼIIやタンパクキナーゼCなどのリン酸化酵素を活性化し[44-46]、最終的にシナプス後膜が機能的AMPA受容体を獲得して神経伝達効率が増大する[47]というカスケードが想定されている。一方、苔状線維のLTPではNMDA受容体の活性化は必要なく[48]、むしろシナプス前終末のP型Caチャネル[49]の活性化に伴う細胞内Caイオンの上昇により、カルモジュリンを介してI型アデニリルシクラーゼを賦活化する[50]。これにより産生した環状AMPがタンパクキナーゼA(PKA)を活性化して[51]、Rab3を介し[52]グルタミン酸の放出量を増大させるという機構が考えられている。すなわち、苔状線維のLTPの形成機構には一般的なLTPとの分子的な共通部分はなく、その特殊性からも興味深い研究対象となっている。 9)てんかん患者またはそのモデル動物において苔状線維の異常発芽が観察される[53-55]。苔状線維のシナプス終末は、通常CA3野透明層と歯状回門に分布している。しかし、側頭葉けいれん発作を発したヒトあるいは実験動物では、苔状線維がCA3野上昇層(stratum oriens)または歯状回内側分子層に異常発芽することが知られている。この現象が注目される理由は、結果として海馬神経ネットワークのパターンが変化する点にある[53]。すなわち、苔状線維の異常発芽により、海馬の生理的機能が変容する可能性がある。特に歯状回顆粒細胞に反回性回路を直接形成することから[56]、歯状回の興奮性が上昇し、てんかんの悪化や慢性化の引き金になると考えられる。 なぜ海馬苔状線維なのか? 既に言及した様に、苔状線維は他の中枢神経系には見られない特性を示す。特に「疾患」との関連に関しては古くから議論されており、私のこれまでの研究でも主眼を置いてきた。しかし、なぜ苔状線維だけにこうした現象が観察されるのであろうか。これは、私の様な研究を行う上で常居する根本的疑問であり、中枢神経系の機能や疾患を巨視的に掌握する上で解決される必要のある課題でもある。しかしながら、現時点ではこの問に対する満足のいく回答は得られていない。 近年、Dudekらは、この疑問に対し興味深い提言をしている[57]。要約すれば「他の神経組織とは異なり、苔状線維にはTimm染色という選択的な染色法が存在する。すなわち苔状線維は比較的容易に研究可能な唯一の脳部位であり、てんかん等では海馬の全ての部位に病変が生じているのであろうが、われわれ研究者には苔状線維の研究のみしか許されていない」という考えである。これは部分的には正しいと思われる。実際にてんかんの研究で、CA1野の変性に関する報告例も多少ではあるが存在する[58]。また、私が博士課程の研究で明らかにした様に、てんかん様条件下で重篤な障害を受けるのは形成中の線維であり、これは苔状線維に限らずSchaffer側枝でも同様であった。 しかし、最も重要なことは、Schaffer側枝などの苔状線維以外の神経線維は、胎生期に既にその形成を完了しているという事実である。てんかん様の環境に対して最も高い感受性を示す過程が「発達過程」ということであれば、生後に形成される苔状線維が生後早期に頻発するてんかんの影響を最も受け易いことは自明である。したがって、てんかんで苔状線維の可塑性がしばしば取り上げられる理由は、苔状線維が容易な研究対象となるということではなく、苔状線維の形成時期が生後であるという点にあると考えられる。すなわち、これまでの疑問の論点は「なぜ苔状線維は生後に形成されるのか」という点に集約されると思われる。 それでは、苔状線維が生後に形成されることの利点は何であろうか。これへの回答は逆に、一般的な神経組織はどうして胎生期に形成されるのかという疑問にもつながる。神経系は言うまでもなく生命の維持に必須な根源的活動を管理する枢要な組織である。そして、この規矩は個体の生涯を通じて貫徹する不変の基礎規程である。逆に、この制御機構の崩壊は個体の終焉への危機を示顕している。この崩壊を生じないために、中枢神経系は可塑性や再生を認可しない堅固たる構造を持続する必要がある。これが中枢神経系が胎生期に形成される理由であると考えられる。これにより誕生時に構築されていた神経構成は死ぬまで保持されるのである。これこそが生命維持のために生体が採用した最良の手段であったのであろう。 しかし、これだけでは生命の維持は困難である。生体がより延命するためには外界への適応能力を併せ持つ必要がある。臨機応変に外界の変化に適応すること、換言すれば認知-学習-記憶-変成という行為、このために必要な性質こそが可塑性である。可塑性は生理学的可塑性と構造学的可塑性に分類されるが、生体は生命維持のためにこうした可塑性という特性も一方で必要とした。神経組織が恒性と可塑性という相反する両現象を具有しているのは、まさにそうした理由が根幹にあるのであろう。 ここで重要なことは、生体制御の変容を意味するこの可塑性という性質は一方で、制御機構の崩壊すなわち生体機能障害(疾患)という危殆と隣接しているという点である。この危険性を最小限に抑留するために生体が採用した手段は、可塑性を与える神経組織を限局するという方法である。 古くから記憶、学習に重要な脳部位であるとされている海馬で可塑性という現象が極めて屡次に観察されるということは、海馬こそが選ばれた神経組織であることを示している。なかでも苔状線維に見られる可塑性は顕著である。そして、この線維だけが生後に形成される理由は、より高次の可塑性を与えるためなのであろう。一般に形成された直後の線維は高い生理学的可塑性を示すし、なによりも、生後に次々と形成させることで神経回路の様態を大胆に変化させ構造学的可塑性を表現することが可能となる。しかも、苔状線維は興奮性神経であるにも関わらず例外的に無髄軸索である。ミエリン鞘は可塑性や再生の妨碍となる[59]ことを考慮すれば、無髄軸索であるという点は高度な可塑性を発現するために極めて有利に作用すると言える。 この様に生体は、苔状線維という神経組織に対してとりわけ高度な可塑性を認可し、また、そのために苔状線維のみに用意周到な機構を与えている。裏を返せば、この理由で、苔状線維は、疾患という病理レベルに最も近い神経組織となってしまった。苔状線維には、疾患という危険因子を代償として、高次な可塑性を支持するための分子機構が施与されている。 これが本節の最初で行った問いかけへの回答であると考えている。 参考文献 1. Gaarskjaer FB: The organization and development of the hippocampal mossy fiber system. Brain Res 396:335-357, 1986. 2. Henze DA et al.: The multifarious hippocampal mossy fiber pathway: a review. Neuroscience 98:407-427, 2000. 3. Gutierrez R: Activity-dependent expression of simultaneous glutamatergic and GABAergic neurotransmission from the mossy fibers in vitro. J Neurophysiol, 87:2562-2570, 2002. 4. Walker MC et al.: Monosynaptic GABAergic signaling from dentate to CA3 with a pharmacological and physiological profile typical of mossy fiber synapses. Neuron 29:703-715, 2001. 5. Amaral DG, Witter MP: The three-dimensional organization of the hippocampal formation: a review of anatomical data. Neuroscience 31:571-591, 1989. 6. Swanson LW et al.: An autoradiographic study of the organization of intrahippocampal association pathways in the rat. J Comp Neurol 181:681-715, 1978. 7. Acsady L et al.: GABAergic cells are the major postsynaptic targets of mossy fibers in the rat hippocampus. J Neurosci 18:3386-403, 1998. 8. Amaral DG, Witter MP: Hippocampal formation (Paxinos, G., The rat nervous system), pp. 443-492, Academic Press (San Diego) 1995. 9. Amaral DG et al.: Neurons, numbers and the hippocampal network. Prog Brain Res 83:1-11, 1990. 10. Andersen P et al.: Location and identification of excitatory synapses on hippocampal pyramidal cells. Exp Brain Res 1:236-248, 1966. 11. Andersen P et al.: Lamellar organization of hippocampal excitatory pathways. Exp Brain Res 13:222-238, 1971. 12. Hayashi H, Ishizuka S: Chaotic responses of the hippocampal CA3 region to a mossy fiber stimulation in vitro. Brain Res 686:194-206, 1995. 13. Blackstad TW, Kjaerheim A: Special axo-dendritic synapses in the hippocampal cortex: electron and light microscopic studies on the layer of mossy fibers. J Comp Neurol 117:133-146, 1961. 14. Hamlyn LH: The fine structure of the mossy fibre endings in the hippocampus of the rabbit. J Anat 96:112-126, 1962. 15. Claiborne BJ et al.: A light and electron microscopic analysis of the mossy fibers of the rat dentate gyrus. J Comp Neurol 246:435-458, 1986. 16. Chicurel ME, Harris KM: Three-dimensional analysis of the structure and composition of CA3 branched dendritic spines and their synaptic relationships with mossy fiber boutons in the rat hippocampus. J Comp Neurol 325:169-182, 1992. 17. Salin PA et al.: Distinct short-term plasticity at two excitatory synapses in the hippocampus. Proc Natl Acad Sci USA 93:13304-13309, 1996. 18. Kamiya H et al.: Activation of metabotropic glutamate receptor type 2/3 suppresses transmission at rat hippocampal mossy fibre synapses. J Physiol 493:447-455, 1996. 19. Kamiya H: Kainate receptor-dependent presynaptic modulation and plasticity. Neurosci Res 42:1-6. 20. Schmitz, D et al.: Synaptic activation of presynaptic kainate receptors on hippocampal mossy fiber synapses. Neuron 27:327-338, 2000. 21. Schmitz D et al.: Presynaptic kainate receptor mediation of frequency facilitation at hippocampal mossy fiber synapses. Science 291:1972-1976, 2001. 22. Semyanov A, Kullmann DM: Kainate receptor-dependent axonal depolarization and action potential initiation in interneurons. Nat Neurosci 4:718-723, 2001. 23. Maske H: Uber den topochemischen nachwels von zink im ammonshorn verschiedener saugetiere. Naturwissenschaften 42, 424, 1955. 24. Assaf SY, Chung S-H: Release of endogenous Znイオン from brain tissue during activity. Nature 308:734-736, 1984. 25. Howell GA et al.: Stimulation-induced uptake and release of zinc in hippocampal slices. Nature 308:736-738, 1984. 26. Ueno S et al.: Mossy fiber Znイオン spillover modulates heterosynaptic N-methyl-D-aspartate receptor activity in hippocampal CA3 circuits. J Cell Biol 158:215-220, 2002. 27. Cole TB et al.: (1999). Elimination of zinc from synaptic vesicles in the intact mouse brain by disruption of the ZnT3 gene. Proc. Natl Acad Sci USA 96:1716-1721, 1999. 28. Ibata Y, Otsuka N: Electron microscopic demonstration of zinc in the hippocampal formation using Timm's sulfide silver technique. J Histochem Cytochem 17:171-175, 1969. 29. Altman J, Das GD: Autoradiographic and histological evidence of postnatal hippocampal neurogenesis in rats. J Comp Neurol 124:319-335, 1965. 30. Kaplan MS, Hinds JW: Neurogenesis in the adult rat: electron microscopic analysis of light radioautographs. Science 197:1092-1094, 1977. 31. Amaral DG, Dent JA: Development of the mossy fibers of the dentate gyrus: I. A light and electron microscopic study of the mossy fibers and their expansions. J Comp Neurol, 195:51-86, 1981. 32. Shors TJ et al.: Neurogenesis in the adult is involved in the formation of trace memories. Nature 410:372-376, 2001. 33. van Praag H et al.: Functional neurogenesis in the adult hippocampus. Nature 415:1030-1034, 2002. 34. Gould E et al.: Adult-generated hippocampal and neocortical neurons in macaques have a transient existence. Proc Natl Acad Sci USA 98:10910-10917, 2001. 35. Gould E, Gross CG: Neurogenesis in adult mammals: some progress and problems. J Neurosci 22:619-623, 2002. 36. McNaughton BL et al.: Hippocampal granule cells are necessary for normal spatial learning but not for spatially-selective pyramidal cell discharge. Exp Brain Res 76:485-496, 1989. 37. Nicoll RA, Malenka RC: Contrasting properties of two forms of long-term potentiation in the hippocampus. Nature 377:115-118, 1995. 38. Bliss TV, Collingridge GL: A synaptic model of memory: long-term potentiation in the hippocampus. Nature 361:31-39, 1993. 39. Mayer ML et al.: Voltage-dependent block by Mg2+ of NMDA responses in spinal cord neurones.Nature 309:261-263, 1984. 40. Nowak L et al.: Magnesium gates glutamate-activated channels in mouse central neurones. Nature 307:462-465, 1984. 41. Harris EW et al.: Long-term potentiation in the hippocampus involves activation of N-methyl-D-aspartate receptors. Brain Res 323:132-137, 1984. 42. Herron CE et al.: Frequency-dependent involvement of NMDA receptors in the hippocampus: a novel synaptic mechanism. Nature 322:265-268, 1986. 43. Morris RG et al.: Selective impairment of learning and blockade of long-term potentiation by an N-methyl-D-aspartate receptor antagonist, AP5. Nature 319:774-776, 1986. 44. Akers RF, et al.: Translocation of protein kinase C activity may mediate hippocampal long-term potentiation. Science 231:587-589, 1986. 45. Malenka RC et al.: An essential role for postsynaptic calmodulin and protein kinase activity in long-term potentiation. Nature 340:554-557, 1989. 46. Malinow R et al.: Inhibition of postsynaptic PKC or CaMKII blocks induction but not expression of LTP. Science 245:862-866, 1989. 47. Harris EW, Cotman CW: Long-term potentiation of guinea pig mossy fiber responses is not blocked by N-methyl D-aspartate antagonists. Neurosci Lett 70132-137, 1986. 48. Liao D et al.: Activation of postsynaptically silent synapses during pairing-induced LTP in CA1 region of hippocampal slice. Nature 375:400-404, 1995. 49. Castillo PE et al.: The role of Ca2+ channels in hippocampal mossy fiber synaptic transmission and long-term potentiation. Neuron, 12:261-269, 1994. 50. Sugiyama H et al.: Roles of metabotropic and ionotropic glutamate receptors in the long-term potentiation of hippocampal mossy fiber synapses. Adv Exp Med Biol, 268:387-394, 1990. 51. Weisskopf MG, et al.: Mediation of hippocampal mossy fiber long-term potentiation by cyclic AMP. Science, 265:1878-1882, 1994. 52. Huang YY et al.: cAMP contributes to mossy fiber LTP by initiating both a covalently mediated early phase and macromolecular synthesis-dependent late phase. Cell, 79:69-79, 1994. 53. Castillo PE et al.: Rab3A is essential for mossy fibre long-term potentiation in the hippocampus. 388:590-593, 1997. 54. McNamara JO: Cellular and molecular basis of epilepsy. J Neurosci 14:3413-3425, 1994. 55. Represa A, Ben-Ari Y: Kindling is associated with the formation of novel mossy fibre synapses in the CA3 region. Exp Brain Res 92:69-78, 1992. 56. Sutula T et al.: Mossy fiber synaptic reorganization in the epileptic human temporal lobe. Ann Neurol 26:321-330, 1992. 57. Dudek FE et al.: Functional significance of hippocampal plasticity in epi-leptic brain: electrophysiological changes of the dentate granule cells associated with mossy fiber sprouting. Hippocampus, 4:259-265, 1994. 58. Meier CL, Obenaus A, Dudek FE: Persistent hyperexcitability in isolated hippocampal CA1 kainate-lesioned rats. J Neurophysiol, 68:2120-2127, 1992 58. Davis SJA et al.: Regeneration of adult axons in white matter tracts of the central nervous system. Nature, 390:680-683, 1997. * 以上は『動くシナプスと神経ネットワーク』(金芳堂、塩坂貞夫編)に寄せた文章と、私の博士論文を元に改編したものです |