| 脳は外部情報が与えられなくても常に自発的に活動している。外界から孤立した神経細胞の活動は無用なノイズとして解釈されてきたが、近年こうした自発活動には偶発レベルを越えた「秩序」が潜んでいることが明らかになった。とりわけ、感覚系からの入力があると流動的だった自発活動が特定ノイズの時空パターンに固定されることから、外部刺激は神経応答を誘発するのではなく、遷移する内部状態から特定の「相」を選択する役割を演じていると解釈される。つまり、受動的な静的システムとしてではなく、内発的に情報を生み出し自己を書き換えうる創生システムとして脳を捉えなおす必要がある。 はじめに 光、音、臭い、味、触覚 ── 外部からの情報が、脊髄や脳に送られ、そこに存在する神経細胞によって加工・処理されることは、もはや誰も疑う人はいないだろう。とりわけ高次な情報処理は主に大脳皮質(およびその周辺)で行われるが、しかし、詳細なメカニズムはわかっていない。 不明なものに対する実験的アプローチとして古来よく使われる方法は、未解明の部分をブラックボックスとして扱い、そのブラックボックスの入出力相関を観察するというものである。皮質研究の場合、ブラックボックスは個々の神経細胞であったり、神経回路であったり、もしくは大脳皮質そのものであったりする。 こうしたアプローチ方法は、もちろん、「ブラックボックスは入力に応じて特異的に反応する」ことを暗黙の前提としている。つまり脳や神経が“外部入力に応じた反応をする”ということが必要条件である。外部の情報がこうして上位に伝えられる流通はボトムアップ処理と呼ばれる。 しかし、大脳皮質を対象にした場合には、この前提が崩れる。皮質の神経細胞は外からの入力がなくても恒常的に独自の発火活動をしているのである。ときには入力が与えられなくても内発的に出力することさえある。こうしたブラックボックスの内部活動は「自発活動(spontaneous activity)」もしくは「継続活動(ongoing activity)」と呼ばれ、脳のパフォーマンスを特徴づける現象である。本稿では、大脳皮質の自発活動に着目しながら、最近の研究の動向を紹介したい。 自発活動の意味 自発活動を考えるとき、まず問われる点は、そもそも何のために脳が自発的に活動しているのかという点である。そこに存在する以上、それなりの意味があるのではないと考えるのは自然だろう。たとえば光のない暗闇でも視覚野は常に活動しているし[1]、睡眠中でも脳は活動を停止することはない。むしろ睡眠中の方が神経細胞の発火頻度が高いことさえある[2]。さらに、動物の開眼前の視覚野、すなわち、外界刺激にさらされた経験のない神経細胞でも、すでに自発活動を開始している[3]。脳は一生働いているのである。 自発活動の存在自体は電気生理学の手法が開発されると同時に確認されている。当時これは「背景ノイズ(background noise)」と名づけられ、現在でもこう呼ぶ研究者は少なくない。外界とは無関係な“無意味”な活動という意味が込められているのだろう。実際、自発発火のパターンは一見すると無秩序に思えるし(図1A)、また、スパイクの間隔もポアソン分布に従うことが知られている(ランダムな現象はポアソン分布に従う)。こうした観察から従来は、皮質の自発活動はそのパターン自体が無秩序であり、それゆえに特別な意味は持っていないと結論付けられてきた。 しかし近年、この考え方が短絡的であることが、いくつかの証拠から明らかになってきている。 第一に、たとえ自発活動が本当にノイズであったとしても、ノイズはそもそも無意味ではない。神経系に限らず一般にノイズ(揺らぎ)はシステムに対して積極的な役割がもつことが多い。この視点でAndersonらの論文は興味深い[4]。 彼らは特定の線軸方向に選択的に反応する第一次視覚野の応答(方位選択性、orientation selectivity)のチューニング機構に着目した。視覚野では、光刺激のコントラストが強いときでも弱いときでも、その反応選択性が変化しないようにバランスが取られている。しかし、単純ボトムアップ処理では刺激のコントラストが低下すれば必ず反応幅も狭くなるため、こうした恒常性を説明できない。Andersonらはこの理由をノイズに求め、弱い刺激の時にはノイズが加算されることで神経の反応性が高められていることを発見した[4]。 従来の考えではノイズは情報の質を低下させる悪者として捕らえられていたが、この例ではノイズはむしろ反応性を高める。このように弱い情報の検出力がノイズによって促進される現象は「確率共振(stochastic resonance)」と呼ばれ、様々な物理システムに見出すことができる非線形現象である[5]。皮質数理モデルによれば、周辺回路からの側方入力が確率共振のためのノイズ源になりうることが指摘されている[6]。
自発活動に潜む隠れた法則 大脳皮質の自発活動は人工的な状態、たとえば、麻酔下やスライス標本においてさえも消失することはない。とりわけ、スライス標本に自発活動が存在するという事実から[7,8]、自発発火を生じるためには限られた局所回路で必要十分であることが伺える。逆に、皮質スライス標本を活用できる利点を活かし、近年、膨大数の神経細胞から大規模な記録を行うことで、皮質の自発活動の実態が明るみになった(図1A)[8-10]。 こうした中、何よりも重要な発見は、従来ランダムであると考えられていた自発活動は、巨視的に眺めると厳然たる「秩序」を含んでいたことであろう。もっとも顕著な秩序は、複数の神経細胞が同時に(もしくは限られた時間幅の中で一斉に)活動する現象「同期(synchronization)」である[8-9]。この同期活動を高い時間分解能でさらに詳細に調べると、幾多の神経細胞が特定の順番で特定の相対タイミングをもって活動しており、結果として、特定の発火パターンが何度も反復されていることがわかった(図1B)[8,10]。 観察される発火活動の時空構造を、コンピュータを用いてランダムにシャッフル(制限付きモンテカルロ・シミュレーション)すると、そこに含まれる繰り返しパターン数が大幅に減少することから、偶然による時空活動では、反復活動を説明できないことがわかる[8,10]。 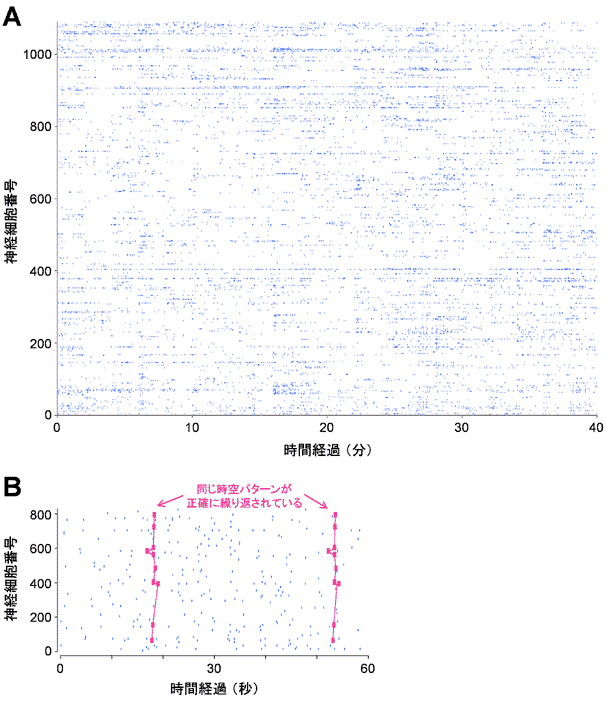 図1 大脳皮質の自発活動パターン A カルシウム蛍光指示薬を用いて再構築した発火活動の時空パターン。マウス内側前頭葉スライス標本。1000を超える神経細胞から40分間にわたって記録した。縦軸が細胞番号(任意に割り当てた)、横軸は時間軸を示している。神経細胞が活動した各時間を点で示している(こうした表記法はラスター図と呼ばれる)。時空パターンは一見すると無秩序に見える。B 自発的な発火活動には時空パターンの反復が観察される。 Izhikevichらは皮質神経回路の詳細な解剖学的知見に忠実に10万個のモデル神経細胞からなる巨大な人工神経回路を構築した[11]。さらに興奮性と抑制性のバランス、内因性発火パターン、受容体チャネルの反応速度、軸索伝導速度、短期シナプス可塑性やスパイクタイミング依存性可塑性などを注意深く組み込み、神経回路がどのような挙動を示すかをシミュレーションした。すると個々の神経細胞は初期にはランダムな活動を示していたものの、しだいに特定の活動パターンを繰り返すようになった。これは「教師なし(unsupervised)」で自発的に獲得された形質である。このことから神経回路は主体的に活動を組織化する性質をもっていることがわかる。また、自発的同期活動の時空サイズの分布はベキ則に貫かれているため、自己組織臨界現象として解釈される可能性があり、こうした憶測からBeggsら神経同期現象を「神経雪崩(neuronal avalanche)」と呼んでいる[12]。 このような同期的な活動パターンにはどんな利点があるだろうか。Diesmannらの研究がヒントを与えてくれる[13]。一般に、皮質回路の結合性はまばらで、個々のシナプスの挙動も確率的で不安定ある。彼らは数理計算によって、個々の神経活動が同期すれば、こうした心もとない回路を時間正確性を保ちながら安定して伝播することができることを明らかにしている。この現象は「同期発火連鎖(synfire chain)」と名づけられており、皮質回路の挙動を安定させる役割を果たしていると想定される[10]。また、同期性は物理的に安定な状態に向かう性質を持っており、回路挙動はアトラクターダイナミクスに基づいていることが示唆される[9,13]。
外部刺激と自発活動の関係 神経活動パターンの繰り返しにどんな生理的な意味があるだろうか。Wilsonらは海馬の場所細胞について興味深い知見を報告している[14]。場所細胞とは動物が今いる場所に特異的に反応する神経細胞である。彼らは探索行動中に同期活動した場所細胞のペアは、その後の睡眠中にも同期活動する傾向があることを発見した。このようにして反復される同期活動は記憶を長期に固定化するプロセスと考えられる。 Kenetらの発見はこの解釈をさらに拡大する[15]。彼らは電位感受性色素を用いて視覚野の方位選択性マップを決定した。視覚刺激がないときにも、もちろん、皮質は自発活動している。彼らはその自発活動のパターンが、視覚刺激があるときに現れる方位選択性マップときわめて類似していることを見出した。視覚入力がないときにも、さまざまな方向に選択的な反応が、数百ミリ秒おきに自然に現れては推移するという活動を延々と続けていた。このことから、皮質回路には幾多の「内部状態(internal state)」があらかじめ存在し、刺激がないときにはその複数の状態を持続的に遷移しているが、外部刺激によって特定の内部状態に固定されると考えられる。 この考えを支持する知見は多く、Fiserらは視覚野の発火活動を記録し、自発活動と刺激応答とで同期活動のレベルには従来想定されたほど顕著な差がないことを報告している[16]。またMakeigらは脳波を独立成分分析によって基礎成分に分解し、刺激に対する脳波変化を追跡した[17]。脳波は神経同期活動の現れである。彼らは、刺激によって惹起される脳波の変化は、振幅の増減ではなく、むしろ位相のリセットによるものであることを見出した。こうした調節法はコミュニケーション論でいうところの「位相変調(phase modulation)」に相当し、この事実もまた、外界刺激は、反応を惹起させるのでなく、内部状態を選択するだけであるという説を支持している。
神経ネットワークと神経細胞の内部状態 皮質神経の安定な内部状態が、神経細胞同士で同期して生じるUP状態によって与えられることが近年報告された[9]。UP状態とは、静止膜電位が通常より10 mVほど脱分極した状態に維持される状態をさす。逆に通常の静止膜電位をDOWN状態という。すなわち神経細胞はUP状態とDOWN状態の二つの安定な状態を自発的に推移している(図2)。発火活動がみられるのは通常UP状態においてである。このように内発的に生み出される安定状態は動的な多重アトラクターであると解釈されるが、これが単一細胞レベルで生じるのか[18]、回路レベルで規定されるのかは議論の分かれるところである[19]。ただ、UP/DOWN遷移が隣接する細胞間で同期していることも知られており[20,21]、多くの場合、内部状態の同期は再帰性入力によって支えられるものと想定される[19,22]。また、こうした神経活動の同期遷移の巨視的挙動は、非平衡統計力学における「Landauの臨界現象モデル」によって擬似化できることから、内部状態の遷移は同期回路の「相転移(phase transition)」に相当する可能性がある[22]。 一方、神経細胞がUP状態にあるかDOWN状態にあるかで、同じ外部刺激が与えられても、異なった応答を示すことが知られている[22-25]。こうした多様性は、上述したような自発活動と刺激応答の独特な関係性に絡んでいる可能性がある。この点については今後の研究の進展を待ちたい。 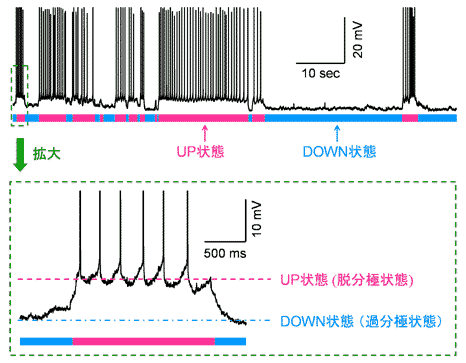 図2 静止膜電位の多重安定性 マウス内側前頭葉の錐体細胞からのホールセル細胞内記録。静止膜電位はUP状態とDOWN状態という二つの安定な状態を自発的に遷移している。ほとんどの発火はUP状態のときに生じる。
おわりに 脳をシステムとして捉えなおすと、マクロにもミクロにもその自己創発性が鍵を握っている。脳はしばしばコンピュータに比較されてきたが、基本的に外部入力がなければ作動しないコンピュータとは異なり、脳は常に活動的であり自発的に内部状態を生み出している。外部情報はそれを微調節するか、もしくは規定の内部レパートリから特定の状態を選択するだけであるらしい。こうした最近の知見から、皮質の情報処理システムは単純なフィードフォーワード系ではなく、オートポイエーシスに基盤を置いていることが想像される。従来の多くの研究が、入出力相関の探索に焦点を当てているが、この路線のみでは脳の真の姿は捉えることはできない。自発活動の発生機構と内部構造、これと刺激応答との関係を対等に考慮していくことが、大脳生理学が採択するべき次のステップであるように私は思う。
参考文献 1) Fiser, J., Chiu, C. & Weliky, M.: Nature, 431:573-578, 2004 2) McCormick, D. A.: Science, 285:541-543, 1999 3) Weliky, M. & Katz, L. C.: Science, 285:599-604, 1999 4) Anderson, J. S., Lampl, I., Gillespie, D. C. & Ferster, D.: Science, 290:1968-1972, 2000 5) Wiesenfeld, K. & Moss, F.: Nature, 373:33-36, 1995 6) Stemmler, M., Usher, M. & Niebur, E.: Science, 269:1877-1880, 1995 7) Sanchez-Vives, M. V. & McCormick, D. A.: Nat. Neurosci., 3:1027-1034, 2000 8) Mao, B. Q., Hamzei-Sichani, F., Aronov, D., Froemke, R.C. & Yuste, R.: Neuron, 32:883-898, 2001 9) Cossart, R., Aronov, D. & Yuste, R.: Nature, 423:283-288, 2003 10) Ikegaya, Y., Aaron, G., Cossart, R., Aronov, D., Lampl, I., Ferster, D. & Yuste R.: Science, 304:559-564, 2004 11) Izhikevich E. M., Gally, J. A. & Edelman, G. M.: Cereb. Cortex, 14:933?944, 2004 12) Beggs, J. M. & Plenz, D., J. Neurosci.: 23:11167-11177, 2003 13) Diesmann, M., Gewaltig, M. & Aertsen, A.: Nature, 402:529-533, 1999 14) Wilson, M. A. & McNaughton, B. L.: Science, 265:676-679, 2004 15) Kenet, T., Bibitchkov, D., Tsodyks, M., Grinvald, A. & Arieli, A.: Nature, 425:954-956, 2003 16) Fiser, J., Chiu, C. & Weliky, M.: Nature, 431:573-578, 2004 17) Makeig, S., Westerfield, M., Jung, T. P., Enghoff, S., Townsend, J., Courchesne, E., Sejnowski, T. J.: Science, 295:690-694, 2002 18) Egorov, A. V., Hamam, B.N., Fransen, E., Hasselmo, M. E. & Alonso, A. A.: Nature, 420:173-178, 2002 19) Shu, Y., Hasenstaub, A. & McCormick, D. A.: Nature, 423:288-293, 2003 20) Stern, E. A., Jaeger, D. & Wilson, C. J.: Nature, 394:475-478, 1998 21) Lampl, I., Reichova, I. & Ferster, D.: Neuron, 22:361-374, 1999 22) Fujisawa, S., Matsuki, N., & Ikegaya, Y.: submitted for publication 23) Petersen, C. C., Hahn, T. T., Mehta, M., Grinvald, A. & Sakmann, B.: Proc. Natl. Acad. Sci. U. S. A., 100:13638-13643, 2003 24) Shu, Y., Hasenstaub, A., Badoual, M., Bal, T., McCormick, D.A.: J. Neurosci., 23:10388-10401, 2003 25) Brecht, M., Schneider, M., Sakmann, B., Margrie, T. W.: Nature, 427:704-710, 2004 * 以上は『実験医学 2005年5月号 』(羊土社)の特集「行動を司る生命機能メカニズム」(企画:宮川剛)に寄せた文章を元に改変したものです。羊土社の許可を得てここに掲載しております。 |
||||||||||||||||